Tồn dư thuốc gây mê hay chưa giải hết giãn cơ có thể khiến quá trình thoát mê gặp biến chứng. Các tác dụng tồn dư của thuốc có thể dẫn đến suy giảm hoạt động chức năng các cơ vùng hầu, tắc nghẽn đường hô hấp trên, mất khả năng ho hiệu quả, tăng gấp 5 lần nguy cơ hít sặc, và làm giảm xu hướng thiếu oxy của các thụ thể hóa học ngoại biên.[13,14] Giảm thông khí, tụt oxy máu, mất thông thoáng của đường thở có thể là những hậu quả tiếp theo. Dự trữ oxy còn hạn chế nguy cơ gây loạn nhịp của neostigmine.[15] Vì thế, dữ trữ oxy “thường quy “trước khi giải giãn cơ hay trước khi rút NKQ đều được khuyến cáo, bởi những vấn đề về thông khí và đường thở có thể có nói trên.[16] Hướng dẫn rút NKQ 2012 của hiệp hội đường thở khó Anh quốc cho rằng: Dự trữ oxy trước khi rút NKQ có ý nghĩa sống còn vì có nhiều thay đổi sinh lí và giải phẫu của đường thở trong và sau phẫu thuật có thể làm hạn chế trao đổi khí.[17] Dự trữ oxy cũng được khuyến cáo trước khi có bất kì sự gián đoạn thông khí nào, ví dụ như trong trường hợp hút khí phế quản hở.[16]
Bài này trình bày cơ sở sinh lý và các lợi ích lâm sàng của dự trữ oxy. Những cân nhắc đặc biệt khi dự trữ oxy cho các BN nguy cơ cao cũng được bàn tới. Từ nhiều năm qua, mối quan ngại về các tác dụng không mong muốn của dự trữ oxy cũng đã được nhắc tới trong các y văn. Có thể kể đến: Chậm phát hiện đặt nhầm NKQ vào thực quản, xu hướng xẹp phổi hấp thụ, tạo ra các chất ô xy hóa, hay những thay đổi bất lợi trên huyết động. Chúng tôi miêu tả các ảnh hưởng này và bàn luận xem liệu chúng có làm thay đổi cách dự trữ oxy hay không trong những trường hợp lâm sàng cụ thể
Dự trữ oxy: Cơ sở sinh lý, hiệu quả và hiệu lực
Dự trữ oxy tăng lượng oxy dự trữ trong cơ thể, phần gia tăng chủ yếu nằm ở dung tích cặn chức năng. Mức tăng oxy trong các mô khác nhau rất khó để đánh giá chính xác, nhưng nếu giả sử hệ số tan của các khí trong máu xấp xỉ bằng hệ số tan của các khí trong nước, thì mức độ tăng oxy ước tính ở các mô có thể đánh giá được (bảng 1, hình 1).[18,19] Tác dụng của dự trữ oxy được đánh giá bằng hiệu quả và hiệu lực của nó. Các chỉ số thể hiện tính hiệu quả là: Tăng nồng độ oxy phế nang (FAO2),[20–22] giảm nồng độ nitơ phế nang (FAN2),[23,24] tăng áp xuất oxy trong máu (PaO2).[25–27] Tính hiệu lực được đánh giá bằng mức độ giảm bão hòa oxyhemoglobin (SaO2) trong quá trình ngừng thở.[28–30]

Hình 1.
Thay đổi thể tích oxy dự trữ trong: Dung tích cặn chức năng (□), máu (▴),mô (^), và toàn bộ cơ thể (▪) theo thời gian dự trữ oxy. (Sử dụng với sự cho phép của Campbell and Beatty).19
Dự trữ oxy làm tăng FAO2 và giảm FAN2 (Figure 2).[31] Mấu chốt để đạt được dự trữ oxy tối đa là đuổi được nitơ khỏi phế nang. Thuật ngữ: Dự trữ oxy và đuổi nitơ được sử dụng tương đương để chỉ cùng một quá trình. Ở những cá thể có chức năng phổi bình thường, quá trình lấp đầy oxy và đuổi hết khí nitơ trong lòng phế nang là một hàm số mũ và bị chi phối bởi hằng số thời gian (t) của các đường số mũ. Hằng số này tỉ lệ thuận với tỉ số giữa thông khí phế nang và dung tích cặn chức năng. Vì quá trình dữ trữ oxy trước khi khởi mê thường được thực hiện bằng hệ thống khí nửa kín có bình hấp thụ, nên phải tính cả thời gian đuổi khí trong hệ thống dây bằng cách sử dụng hằng số thời gian của hệ thống này (vốn được tính bằng thời gian cần thiết để một thể tích bằng dung tích bình chứa chảy hết qua bình). Vì vậy, quá trình dự trữ oxy bao gồm 2 pha (bảng 2),[16] : Pha lấp đầy hệ thống dây bằng dòng oxy và pha làm sạch (Nito ở) dung tích cặn chức năng bằng thông khí phế nang. Sau 1t (t là hằng số thời gian) nồng độ oxy trong dung tích cặn chức năng tăng lên đến 63%; sau 2t, đến 86%; sau 3t, đến 95%; sau 4t, lên đến xấp xỉ 98%. Mốc của dự trữ oxy tối đa và đuổi khí nitơ được định nghĩa là nồng độ oxy cuối thì thở ra (EtO2) đạt khoảng 90% và nồng độ khí nitơ cuối thì thở ra (EtN2) khoảng 5%.[19,20] Ở người lớn có dung tích cặn chức năng và mức độ tiêu thụ oxy (VO2) bình thường, EtO2 > 90% thể hiện trong phổi có chứa >2000 mL khí O2, tương đương 8 – 10 lần VO2.[8,32] Do luôn có sự góp mặt của khí CO2 và hơi nước trong thành phần các khí phế nang, nên rất khó đạt được EtO2 >94% .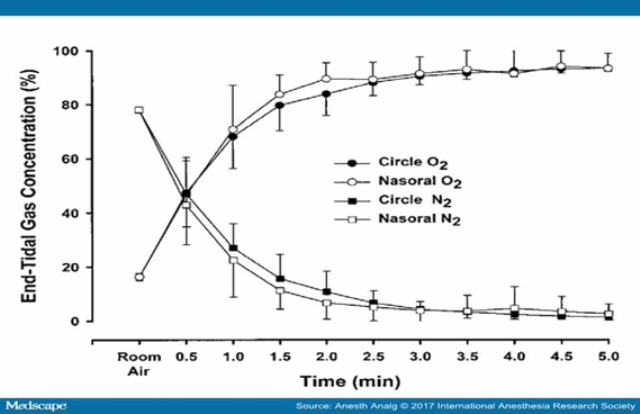
Hình 2.
So sánh nồng độ trung bình của oxy và nitơ cuối thì thở ra tại các thời điểm cách nhau 30s trong vòng 5 phút tự thở bằng thể tích khí lưu thông (thở bình thường) với ô xy qua hệ thống sonde mũi miệng, có bình hấp phụ trên 20 tình nguyện viên. Kết quả hiển thị dưới dạng trung bình ± SD. Dữ liệu sử dụng với sự cho phép của Nimmagadda và cộng sự.31
Có rất nhiều yếu tố ảnh hưởng đến hiệu quả và hiệu lực của dự trữ oxy (bảng 3).[16] Các yếu tố này bao gồm: FiO2, thời gian dự trữ oxy, tỉ lệ giữa thông khí phế nang và thể tích cặn chức năng. Không đạt được FIO2 xấp xỉ 1.0 có thể là do mask bị hở,[34,35] do thở lại khí đã thở ra của nhịp thở trước, hay do sử dụng các loại bóng bóp không có khả năng cung FiO2 cao.[31]
Bệnh nhân có râu quai nón, mất răng, những BN già có má hóp, sử dụng sai cỡ mask, dùng đai buộc đầu không hợp lí, hay có sonde dạ dày là những nguyên nhân phổ biến dẫn đến hở mask, không khí từ môi trường lọt vào làm giảm FIO2. Không thầy đồ thị CO2 bình thường hoặc EtCO2 và EtO2 thấp hơn mong đợi là dấu hiệu báo động cho bác sĩ gây mê biết hệ thống gây mê đang bị hở.[8] FIO2 có thể bị ảnh hưởng bởi thời gian dự trữ oxy, cách thức hít thở, và lưu lượng khí mới (FGF).[36] Cần phải có thời gian nhất định để đạt được dự trữ oxy tối đa. Với FIO2 xấp xỉ 1.0, hầu hết người lớn khỏe mạnh mà hít thở bằng thể tích khí lưu thông có thể đạt được mục tiêu EtO2 > 90% trong vòng từ 3 – 5 phút. Độ trễ thay đổi nồng độ ô xy phế nang (FAO2) sau mỗi lần thay đổi FiO2 tuân theo luật số mũ và được tính bằng phương trình: FAO2 = 0.693 × thể tích ô xy trong dung tích cặn chức năng / thông khí phế nang. Với dung tích cặn chức năng là 2.5 L: Độ trễ này là 26s khi thông phí phế nang là 4L/phút, là 13s nếu thông khí phế nang là 8L/phút .[8] Những khám phá trên cho thấy nếu tăng thông khí sẽ giảm được thời gian cần thiết để dự trữ oxy trong phổi, đây chính là cơ sở của việc sử dụng kĩ thuật thở sâu thay cho kĩ thuật thở bằng thể tích khí lưu thông thông thường.[27,37–39] Có nhiều kĩ thuật dự trữ oxy đã được miêu tả (bảng 4) .[16]
Tăng lưu lượng khí mới (FGF) từ 5 lên 10L không làm tăng đáng kể FIO2 nếu thở bình thường, nhưng thở sâu thì có.[36] Vì đặc điểm của hệ thống dây thở, nên thông khí phút khi thở sâu có thể vượt quá lưu lượng khí mới, dẫn đến việc một phần khí Nitơ trong khí thở ra sẽ bị hít lại, làm giảm FIO2. Tuy nhiên, nếu thở bình thường thì hiện tượng hít lại Nitơ là không đáng kể, chính vì thế khi tăng lưu lượng khí mới từ 5 – 10L ít ảnh hường đến FiO2 .[36] Dù sử dụng kĩ thuật nào thì mục tiêu cuối cùng cũng là để đạt đến mốc dự trữ oxy tối đa vốn có thể dễ dàng theo dõi được trên hầu hết các monitor của máy mê.
Các nghiên cứu chỉ ra rằng, dự trữ oxy làm chậm đáng kể hiện tượng tụt bão hòa oxyhemoglobin máu động mạch trong quá trình ngừng thở.[8,21,23,28] Mức độ làm chậm đến đâu phụ thuộc vào hiệu quả của dự trữ oxy, dung tích oxy được dữ trữ, và mức độ tiêu thụ oxy VO2[8,28] Những BN có suy giảm khả năng vận chuyển ô xy (giảm dung tích cặn chức năng), giảm PaO2, nồng độ ô xy máu động mạch hay lưu lượng tim, và những BN có tăng VO2, bị tụt bão hòa oxyhemoglobin khi ngừng thở nhanh hơn những người khỏe mạnh. Farmery và Roe[40] đã phát triển và đưa vào áp dụng một mô hình trên máy tính mô tả tốc độ tụt bão hòa oxy trong thời gian ngừng thở. Mô hình này đặc biệt hữu ích để phân tích những trường hợp bão hòa tụt xuống dưới 90%. Đây là ngưỡng nguy hiểm cho phép ở người lớn, vì dưới 90%, PaO2 sẽ tụt theo phương thẳng đứng vì đồ thị phân ly oxy – hemoglobin có hình sigma. Một BN khỏe mạnh nặng 70kg, khi FAO2 giảm dần từ 0,87 (FIO2 là 1.0) đến 0.13 (khí trời), thời gian ngừng thở để bão hòa tụt đến 60 % giảm từ 9.9 xuống còn 2.8 phút ( hình 3).[28]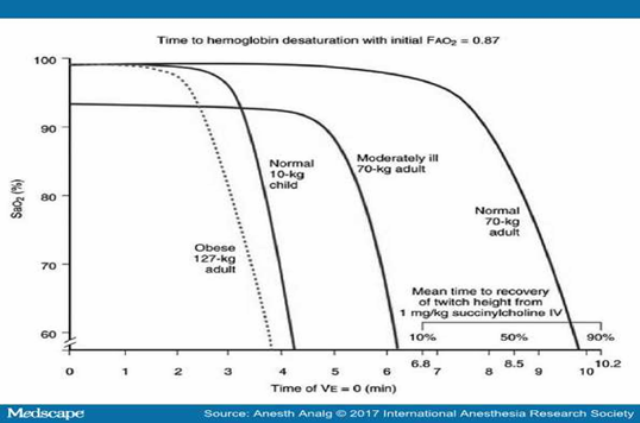
Hình 3.
Mục lục:
Bão hòa oxy máu động mạch (SaO2) theo thời gian ngừng thở của một BN béo phì, một trẻ 10kg có dung tích cặn chức năng thấp nhưng tăng thông khí, một BN người lớn độ nặng trung bình, so với một người khỏe mạnh. FAO2 : Nồng độ oxy trong phế nang, VE: Thể tích khí thở ra. Sử dụng với sự cho phép của BenumoDự trữ oxy cho BN nguy cơ cao
Phụ nữ có thai
Bệnh nhân béo phì bệnh lý
Một vài bác sĩ gây mê hồi sức có thể thích đặt nội khí quản qua nội soi mềm khi BN còn tỉnh hơn là đặt nội khí quản / khởi mê nhanh, cho những BN béo phì nặng và siêu béo phì (BMI > 50 kg/m2), đặc biệt là trong trường hợp có các vấn đề khác kèm theo.[49] Ưu điểm của cách làm này là giúp đảm bảo đường thở thông thoáng khi BN tự thở cho đến khi có thể đặt được NKQ “” một cách không vội vàng”. Cần phải dự trữ oxy qua mask mặt trước, sau đó cung cấp oxy qua canuyl mũi hay canuyl vào ngã ba hầu họng. Một dòng oxy có lưu lượng tối đa lên đến 5L/ phút có thể được thổi liên tục qua kênh trên ống nội soi mềm, dòng oxy này có lợi ích kép: Vừa cung cấp oxy, vừa giúp quan sát tốt hơn vì đẩy được hơi nước và chất tiết khỏi đầu ống nội soi. Cần phải chú ý trong trường hợp đường thở bị tắc nghẽn, khí oxy thổi vào có thể ứ lại trong ống soi mềm, nếu kéo dài có thể gây ra tình trạng chấn thương áp lực. Vì vậy, thận trọng, đừng cường điệu quá mức phương pháp này. Những kĩ thuật tăng cường dự trữ oxy trình bày sau ở trên, là hết sức quan trọng với những BN béo phì nặng và siêu béo phì.
Bệnh nhân nhi
Người già
Bệnh nhân có bệnh lí phổi
Bệnh nhân ở độ cao lớn
Kĩ thuật dự trữ oxy
Để dự trữ oxy hiệu quả, cần một cách tiếp cận cẩn thận. Cần phải giải thích trước cho BN về tầm quan trọng của dự trữ ô xy bằng mask kín. Một khi đã bắt đầu dự trữ oxy, EtO2 và FiO2 cần được theo dõi chặt chẽ. Nếu EtO2 không đạt được đến giá trị mong muốn, người gây mê cần giữ mask bằng cả hai tay và/ hoặc thay một mask mới vừa hơn. Nếu có thể, không nên khởi mê khi EtO2 chưa đạt được 90%
Các kĩ thuật để tăng cường dự trữ oxy
Thổi oxy liên tục khi ngừng thở
Cung cấp oxy khi ngừng thở chỉ có ích khi trước đó BN đã được dự trữ oxy tối đa, đường thở thông thoáng và tỷ lệ dung tích cặn chức năng/ cân nặng cao. Fraioli và cộng sự[75] đã chứng minh rằng những BN có tỉ lệ dung tích cặn chức năng / cân nặng được dự đoán thấp (37 ± 9 mL/kg) không thể chịu được cung cấp ô xy khi ngừng thở quá 5 phút, trong khi những BN có tỷ lệ này cao (53 ± 8 mL/kg) có thể dung nạp được ít nhất 15 phút. Mặc dù PaO2 giảm liên quan trực tiếp tới PAO2, nhưng SaO2 vẫn duy trì được trên 90% chừng nào hemoglobin còn có thể gắn được với oxy tại phổi.[32,71,75] SaO2 chỉ bắt đầu giảm khi lượng oxy dự trữ trong phổi cạn kiệt đồng thời PaO2 giảm dưới 60 mmHg. Khi SaO2 <80%, tốc độ tụt bão hòa sẽ khoảng 30%/phút. Trong trường hợp có tắc nghẽn đường thở, thể tích khí trong phổi giảm nhanh chóng, áp lực trong lồng ngực giảm với vận tốc phụ thuộc vào khả năng giãn nở của phổi và tiêu thụ oxy. Khi tắc nghẽn đường thở được giải quyết, dòng oxy vào phổi phục hồi nhanh chóng, nếu FiO2 cao, quá trình dự trữ oxy sẽ được khôi phục.[32] Một vài nghiên cứu cho thấy, nếu đường thở thông thoáng, kĩ thuật thổi oxy khi ngừng thở có thể duy trì được SaO2 trên 90% đến 100 phút.[71] Khi FIO2 ở mức cao, chỉ cần tăng FiO2 một chút đã khiến cho độ trễ thời gian trước khi bị tụt bão hòa kéo dài rất nhiều, Độ trễ này có được khi tăng FiO2 từ 0.9 lên đến 1.0 lớn hơn nhiều so với khi tăng FiO2 từ 0.21 đến 0.9.[76]
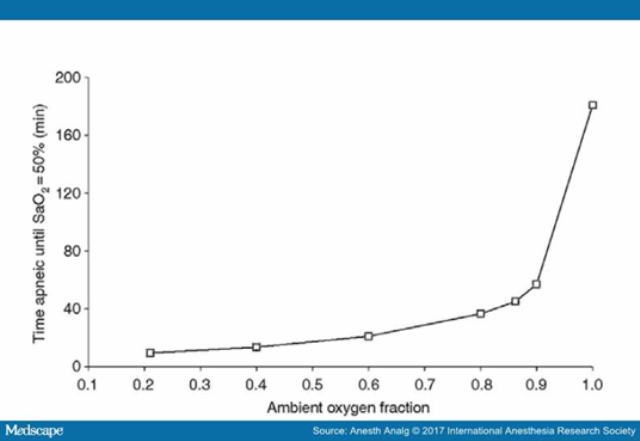
Hình 4.
Thời gian (ngừng thở) cần thiết để bão hòa tụt xuống 50% khi đường thở thông thoáng với ô xy ở các nồng độ khác nhau. Sử dụng với sự cho phép của McNamara và Hardman.76
Cung cấp oxy thì ngừng thở có thể đạt được bằng cách dự trữ oxy tối đa bằng mask, sau đó cung cấp dòng oxy có lưu lượng lên đến 15L/phút qua canuyl mũi họng, hay miệng họng, hoặc qua một kim đặt xuyên qua màng giáp nhẫn. Ở người khỏe mạnh không có tắc nghẽn đường thở, kĩ thuật này có thể giúp duy trì cung cấp đủ oxy ít nhất là 10 phút. Kĩ thuật được áp dụng trên lâm sàng cho những BN khó đặt NKQ, khó thông khí, và những BN có dự trữ oxy hạn chế. Kĩ thuật này cũng được sử dụng khi soi phế quản và có thể cung cấp đủ thời gian cho những thủ thuật ngoại khoa ngắn trên thanh môn vốn bị cản trở bởi ống NKQ hay bởi động tác thở của BN. Mặc dù có thể duy trì cung cấp oxy trong một thời gian dài hơn, hạn chế của phương pháp này là làm tăng dần CO2 trong thời gian ngừng thở.[74]
Thở áp lực dương liên tục và áp lực dương cuối thì thở ra
Thở áp lực dương hai thì không xâm nhập
Trao đổi thông khí ẩm dòng cao qua mũi (THRIVE)
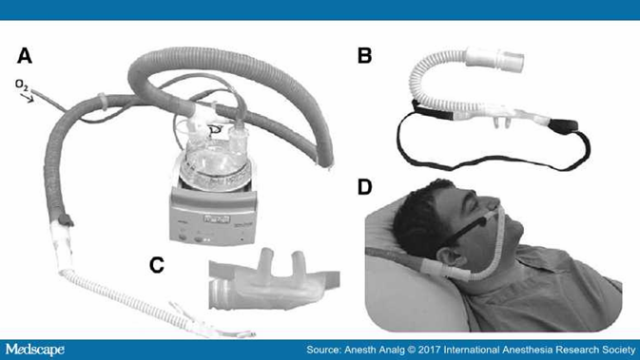
Hình 5.
Hệ thống cung cấp oxy ẩm lưu lượng cao Optiflow. Bộ phận làm ẩm oxy (A) nhận oxy từ nguồn cấp oxy tiêu chuẩn và cung cấp oxy ẩm vào một canuyl thiết kế phù hợp cho mũi (B và C) gần giống như canuyl mũi thông thường (sử dụng với sự cho phép của) Patel and Nouraei.82
Các nguy cơ có thể có của dự trữ oxy
Chẩn đoán chậm đặt NKQ vào thực quản
Xẹp phổi hấp thụ
Các kĩ thuật được đề xuất để hạn chế mức độ xẹp phổi hấp thụ sau dữ trữ oxy là (1) giảm FiO2 và (2) các biện pháp huy động phế nang khác nhau. Các nghiên cứu sử dụng mô hình máy tinh, cũng như các nghiên cứu đánh giá BN thực tế bằng chụp cắt lớp vi tính (CT) chỉ ra rằng giảm FiO2 có ảnh hưởng lớn đến mức độ xẹp phổi.[93–96] Mô hình máy tính về xẹp phổi hấp thu dự đoán nếu dự trữ ô xy với FiO2 bằng 1.0 sẽ đẩy nhanh quá trình xẹp phổi. Một nghiên cứu CT cho thấy nếu BN được thông khí với oxy 30% trong giai đoạn khởi mê thì mức độ xẹp phổi thấp hơn so với khi sử dụng oxy 100%.[94] Một nghiên cứu CT khác đánh giá tác động của biến thiên FiO2 kiểu bậc thang lên với mức độ xẹp phổi và thời gian trước khi tụt bão hòa máu động mạch (Bảng 5).[95] Các nhà nghiên cứu đã khám phá ra rằng (1) xẹp phổi là đáng kể ở những BN nhận oxy 100% nhưng ít và hầu như không có ở những BN nhận oxy lần lượt là 80% và 60% và rằng (2) thời gian tính đến trước khi bị tụt bão hòa giảm khi giảm nồng độ ô xy. Các nghiên cứu cũng đã chứng minh rằng sử dụng oxy 100% khi thoát mê có thể làm tăng xẹp phổi. [96] Benoit và cộng sự cũng nhận thấy có 6.8% BN tỉnh với FIO2 1.0 bị xẹp phổi so với 2.6% ở BN tỉnh với FIO2 là 0.4.
Các biện pháp huy động phế nang thường được sử dụng ở những BN có gây mê toàn thân, nhưng chúng đặc biệt có giá trị khi phối hợp với dự trữ oxy. Các nghiệm pháp này bao gồm CPAP, PEEP, và / hoặc thủ pháp tái nở phổi. Một nghiên cứu trên CT cho thấy, nếu tự thở CPAP 6 cm H20 qua mask trong vòng 5 phút, phối hợp với kiểm soát thông khí qua mask và PEEP 6 cm H20 thêm 5 phút nữa khi khởi mê, sẽ đề phòng được xẹp phổi đáng kể vốn thấy rõ ở nhóm chứng.[77] Thủ pháp tái nở phổi chính là nghiệm pháp “dung tích sống” (bóp bóng tạo áp lực đường thở đến 40cmH2O, rồi giữ 15s). Rothen và cộng sự[97] đã đánh giá động học của việc tái nở phổi xẹp bằng nghiệm pháp “dung tích sống” trong quá trình gây mê toàn thân. Họ nhận thấy rằng, việc tái mở phế nang diễn ra chủ yếu trong khoảng 7- 8s đầu tiên sau khi duy trì đường áp lực đường thở 40 cm H20. Điển hình là thủ pháp này được thực hiện sớm ngay sau khi đặt ống và ngay trước khi rút ống NKQ
Hình thành các chất oxy hóa
Các đáp ứng tim mạch
Một vài nghiên cứu trên đối tượng nam bình thường, đã cho thấy thở oxy 100% làm giảm nhịp tim song hành với giảm lưu lượng tim không đáng kể. Sức cản hệ thống và huyết áp động mạch tăng.[106–108] Những thay đổi này được cho là do phản xạ thông qua nhận cảm áp lực hoặc hóa học. Vì atropin bất hoạt tác dụng hạ nhịp tim, nên đáp ứng này là qua trung gian thần kinh vagal (phó giao cảm).[107]
Một số nghiên cứu sinh lí học đã đánh giá tác động của thở oxy 100% lên tuần hoàn của hệ thống mạch vành người.[109–113] Oxy máu cao trong thời gian dài có thể làm giảm đáng kể lưu lượng tưới máu vành (thể hiện ở hiện tượng co thắt mạch vành), kèm theo giảm tiêu thụ oxy cơ tim. Tác dụng gây co thắt vành trực tiếp của ô xy máu cao là do oxit Nitơ (NO) và các chất giãn mạch giải phóng từ nội mạc mạch máu bị bất hoạt ô xy hóa, và do các kênh K+ nhạy cảm với ATP bị đóng kín.[113,114] Nghiên cứu trên những BN có động mạch vành bình thường cho thấy, mặc dù lưu lượng tưới máu vành giảm, nhưng cung cấp oxy ở mức tế bào cơ tim vẫn đủ, thể hiện ở việc cơ tim tiếp tục tiêu thụ chứ không sản xuất lactat.[108,109] Điều này có thể được giải thích là lượng ô xy trong máu động mạch tăng cao đã khỏa lấp được sự sa sút ô xy do động mạch vành với lưu lượng giảm mang tới, kết hợp với nhu cầu ô xy cơ tim bớt đi do chậm nhịp tim khi ô xy máu cao. Các khám phá về chuyển hóa ở BN có bệnh lí động mạch vành nặng cho kết quả rất khác nhau. Một vài nghiên cứu thấy rằng thở oxy ở những BN này khiến cơ tim chuyển từ sản xuất sang tiêu thụ lactat, điều này gợi ý rằng có thể thở oxy là có lợi. Tuy nhiên lại có những nghiên cứu khác cho thấy thở oxy làm kích thích hay tăng sản xuất lactat ở cơ tim, ngụ ý chỉ những thay đổi do thiếu máu.[110]
Đã chứng minh được rằng sử dụng oxy liều cao cũng có thể gây giảm lưu lượng máu não vì co mạch.[115–118] Người ta đã đưa ra giả thuyết rằng tác dụng nói trên có thể là do, ít nhất là một phần, giảm PaCO2 khi thở ô xy liều cao, hơn là do tác động trực tiếp của oxy.[116] Cơ chế làm giảm PACO2 như sau: Khi PaO2 tăng do thở oxy 100%, đường cong phân li của CO2 bị thay đổi (hiệu ứng Christiansen-Douglas- Haldan), kiểu như ái lực của CO2 với máu giảm. Kết quả là tăng áp lực riêng phần của CO2 và ion dương H + trong tổ chức não, dẫn đến kích thích hô hấp làm giảm PaCO2 gây ra co mạch não..[117,118] Các nhà nghiên cứu cũng đánh giá tác động của tăng oxy máu lên tiêu thụ oxy ở tổ chức não bằng cách sử dụng chụp cộng hưởng từ chức năng. Họ phát hiện ra rằng, tăng oxy máu có thể làm giảm tiêu thụ oxy não khoảng 20%, phản ánh tình trạng giảm hoạt động của tế bào thần kinh.[117] Tình trạng giảm tiêu thụ oxy não được cho là do các chất oxy hóa có khả năng làm tổn hại các lipid và protein, dẫn đến giảm hoạt tính của các enzym tham gia vào quá trình chuyển hóa ái khí.
Các nghiên cứu trên động vật cho thấy tình trạng tăng oxy máu gây ra co mạch và làm giảm lưu lượng máu ở hệ thống mạch ngoại vi, bao gồm có thận, đường tiêu hóa, các chi.[115,119,120] Vẫn chưa rõ co mạch là do tác dụng trực tiếp xủa oxy lên hệ thống cơ trơn thành mạch hay do các phản xạ điều hóa thông qua các receptor hóa học trên động mạch hoặc thông qua các phản xạ thần kinh tự động. Bỏ qua điều đó thì vẫn tồn tại mối quan ngại rằng liệu những thay đổi ở hệ thống mạch ngoại biên có gây ảnh hưởng quan trọng nào trên lâm sàng trong quá trình dự trữ oxy hay không. Những khám phá trên tim mạch cho đến nay không cung cấp đủ căn cứ để hạn chế sử dụng kĩ thuật dự trữ oxy.
Kết luận
Có rất nhiều dữ liệu trong y văn cho thấy dự trữ oxy dù được thực hiện trước khi khởi mê hay khi thoát mê đều làm chậm xuất hiện thiếu ô xy khi ngừng thở. Từ cơ sở đó, dự trữ oxy nên được thực hiện ở tất cả các BN cần gây mê toàn thân. Dự trữ oxy cũng nên được thực hiện bất kì khi nào dự định dừng cung cấp oxy (vd: trong quá trình hút khí phế quản hở, trước và trong quá trình đặt ống NKQ cho BN tỉnh bằng nội soi mềm, đặc biệt là ở những BN có nguy cơ cao (Vd: béo phì nặng). Kĩ thuật dự trữ oxy cần được thực hiện đúng, với sự theo dõi nồng độ oxy trong khí thở ra. Vì các lợi ích của dự trữ oxy có thể không rõ ràng ở những BN nặng, nhiều nghiệm pháp khác nhau có thể được dử dụng để kéo dài hiệu quả của nó. Bác sĩ lâm sàng cần phải làm quen với các nghiệm pháp này. Xẹp phổi hấp thụ trong quá trình dự trữ oxy có thể hạn chế được, vì vậy không nên coi đây là một cản trở việc thực hiện dự trữ ô xy một cách thường quy..
References
- Dillon JB, Darsi ML. Oxygen for acute respiratory depression due to administration of thiopental sodium. JAMA. 1955;159:1114–1116.
- Hamilton WK, Eastwood DW. A study of denitrogenation with some inhalation anesthetic systems.Anesthesiology. 1955;16:861–867.
- Heller ML, Watson TR Jr. Polarographic study of arterial oxygenation during apnea in man. N Engl J Med. 1961;264:326–330.
- Snow RG, Nunn JF. Induction of anaesthesia in the footdown position for patients with a full stomach. Br J Anaesth. 1959;31:493–497.
- Sellick BA. Cricoid pressure to control regurgitation of stomach contents during induction of anaesthesia. Lancet. 1961;2:404–406.
- Wylie WD. The use of muscle relaxants at the induction of anaesthesia of patients with a full stomach. Br J Anaesth. 1963;35:168–173.
- Salem MR, Wong AY, Collins VJ. The pediatric patient with a full stomach. Anesthesiology. 1973;39:435–440.
- Benumof JL. Preoxygenation: best method for both efficacy and efficiency. Anesthesiology. 1999;91:603–605.
- Kung MC, Hung CT, Ng KP, Au TK, Lo R, Lam A. Arterial desaturation during induction in healthy adults: should preoxygenation be a routine? Anaesth Intensive Care. 1991;19:192–196.
- American Society of Anesthesiologists Task Force on Management of the Difficult Airway. Practice guidelines for the management of the difficult airway. Anesthesiology. 2003;98:1269–1277.
- Lake A. A response to ‘Avoiding adverse outcomes when faced with “difficulty with ventilation”‘, Bell D, Anaesthesia 2003;58:945–948. Anaesthesia. 2004;59:202–203.
- Frerk C, Mitchell VS, McNarry AF, et al. Difficult airway society 2015 guidelines for management of unanticipated difficult intubation in adults. Br J Anaesth. 2015;115:827–848.
- Ericson LI. The effects of residual neuromuscular blockade and volatile anesthetics on the control of ventilation.Anesth Analg. 1999;89:243–251.
- Eriksson LI, Sundman E, Olsson R, et al. Functional assessment of the pharynx at rest and during swallowing in partially paralyzed humans: simultaneous videomanometry and mechanomyography of awake human volunteers.Anesthesiology. 1997;87:1035–1043.
- Baraka A. Safe reversal. 1. Atropine followed by neostigmine. An electrocardiographic study. Br J Anaesth. 1968;40:27–29.
- Baraka AS, Salem MR. Preoxygenation. In: Hagberg CA, ed. Benumof and Hagberg’s Airway Management, 3rd ed. Philadelphia, PA: Mosby Elsevier; 2012:657–682.
- Popat M, Mitchell R, Dravid R, Patel A, Swampillai C, Higgs A. Difficult airway society guidelines for the management of tracheal extubation. Anaesthesia. 2012;67:318–340.
- Nunn JF. Oxygen. In: Nunn JF, ed. Nunn’s Applied Respiratory Physiology, 4th ed. Philadelphia, PA: Butterworth-Heinemann; 1993;247–305.
- Campbell IT, Beatty PC. Monitoring preoxygenation. Br J Anaesth. 1994;72:3–4.
- Berry CB, Myles PS. Preoxygenation in healthy volunteers: a graph of oxygen “washin” using end-tidal oxygraphy. Br J Anaesth. 1994;72:116–118.
- Bhatia PK, Bhandari SC, Tulsiani KL, Kumar Y. End-tidal oxygraphy and safe duration of apnoea in young adults and elderly patients. Anaesthesia. 1997;52:175–178.
- Russell GN, Smith CL, Snowdon SL, Bryson TH. Preoxygenation and the parturient patient. Anaesthesia. 1987;42:346–351.
- Carmichael FJ, Cruise CJ, Crago RR, Paluck S. Preoxygenation: a study of denitrogenation. Anesth Analg. 1989;68:406–409.
- Berthoud M, Read DH, Norman J. Pre-oxygenation—how long? Anaesthesia. 1983;38:96–102.
- Archer GW Jr, Marx GF. Arterial oxygen tension during apnoea in parturient women. Br J Anaesth. 1974;46:358–360.
- Gold MI, Duarte I, Muravchick S. Arterial oxygenation in conscious patients after 5 minutes and after 30 seconds of oxygen breathing. Anesth Analg. 1981;60:313–315.
- Baraka AS, Taha SK, Aouad MT, El-Khatib MF, Kawkabani NI. Preoxygenation: comparison of maximal breathing and tidal volume breathing techniques. Anesthesiology. 1999;91:612–616.
- Benumof JL, Dagg R, Benumof R. Critical hemoglobin desaturation will occur before return to an unparalyzed state following 1 mg/kg intravenous succinylcholine. Anesthesiology. 1997;87:979–982.
- Hayes AH, Breslin DS, Mirakhur RK, Reid JE, O’Hare RA. Frequency of haemoglobin desaturation with the use of succinylcholine during rapid sequence induction of anaesthesia. Acta Anaesthesiol Scand. 2001;45:746–749.
- Heier T, Feiner JR, Lin J, Brown R, Caldwell JE. Hemoglobin desaturation after succinylcholine-induced apnea: a study of the recovery of spontaneous ventilation in healthy volunteers. Anesthesiology. 2001;94:754–759.
- Nimmagadda U, Salem MR, Joseph NJ, et al. Efficacy of preoxygenation with tidal volume breathing. Comparison of breathing systems. Anesthesiology. 2000;93:693–698.
- Sirian R, Wills J. Physiology of apnoea and the benefits of preoxygenation. Contin Educ Crit Care Pain. 2009;9:105–108.
- Baraka AS, Salem MR. Preoxygenation. In: Hagberg C, ed. Benumof and Hagberg’s Airway Management, 2nd ed. Philadelphia, PA: Mosby Elsevier; 2007:306
- McGowan P, Skinner A. Preoxygenation—the importance of a good face mask seal. Br J Anaesth. 1995;75:777–778.
- Schlack W, Heck Z, Lorenz C. Mask tolerance and preoxygenation: a problem for anesthesiologists but not for patients. Anesthesiology. 2001;94:546.
- Nimmagadda U, Chiravuri SD, Salem MR, et al. Preoxygenation with tidal volume and deep breathing techniques: the impact of duration of breathing and fresh gas flow. Anesth Analg. 2001;92:1337–1341.
- Gold MI, Duarte I, Muravchick S. Arterial oxygenation in conscious patients after 5 minutes and after 30 seconds of oxygen breathing. Anesth Analg. 1981;60:313–315.
- Gambee AM, Hertzka RE, Fisher DM. Preoxygenation techniques: comparison of three minutes and four breaths. Anesth Analg. 1987;66:468–470.
- Pandit JJ, Duncan T, Robbins PA. Total oxygen uptake with two maximal breathing techniques and the tidal volume breathing technique: a physiologic study of preoxygenation. Anesthesiology. 2003;99:841–846.
- Farmery AD, Roe PG. A model to describe the rate of oxyhaemoglobin desaturation during apnoea. Br J Anaesth. 1996;76:284–291.
- Byrne F, Oduro-Dominah A, Kipling R. The effect of pregnancy on pulmonary nitrogen washout. A study of pre-oxygenation. Anaesthesia. 1987;42:148–150.
- Baraka AS, Hanna MT, Jabbour SI, et al. Preoxygenation of pregnant and non-pregnant women in head-up versus supine position. Anesth Analg. 1991;46:824–827.
- Norris MC, Dewan DM. Preoxygenation for cesarean section: a comparison of two techniques. Anesthesiology. 1985;62:827–829.
- Russel EC, Wrench J, Feast M, Mohammed F. Preoxygenation in pregnancy: the effect of fresh gas flow rates within a circle breathing system. Anaesthesia. 2008;63:833–836.
- Berthoud MC, Peacock JE, Reilly CS. Effectiveness of preoxygenation in morbidly obese patients. Br J Anaesth. 1991;67:464–466.
- Baraka AS, Taha SK, Siddik-Sayyid SM, et al. Supplementation of pre-oxygenation in morbidly obese patients using nasopharyngeal oxygen insufflation. Anaesthesia. 2007;62:769–773.
- Jense HG, Dubin SA, Silverstein PI, O’Leary-Escolas U. Effect of obesity on safe duration of apnea in anesthetized humans. Anesth Analg. 1991;72:89–93.
- Dixon BJ, Dixon JB, Carden JR, et al. Preoxygenation is more effective in the 25 degrees head-up position than in the supine position in severely obese patients: a randomized controlled study. Anesthesiology. 2005;102:1110–1115.
- Gil KSL, Diemunsch PA. Fiberoptic and flexible endoscopic aided techniques. In: Hagberg CA, ed. Benumof’s and Hagberg’s Airway Management, 3rd ed. Philadelphia, PA: Elsevier Saunders; 2013:184–198.
- Butler PJ, Munro HM, Kenny MB. Preoxygenation in children using expired oxygraphy. Br J Anaesth. 1996;77:333–334.
- Morrison JE Jr, Collier E, Friesen RH, Logan L. Preoxygenation before laryngoscopy in children: how long is enough? Paediatr Anaesth. 1998;8:293–298.
- Kinouchi K, Fukumitsu K, Tashiro C, Takauchi Y, Ohashi Y, Nishida T. Duration of apnoea in anaesthetized children required for desaturation of haemoglobin to 95%: comparison of three different breathing gases. Paediatr Anaesth. 1995;5:115–119.
- Laycock GJ, McNicol LR. Hypoxaemia during induction of anaesthesia—an audit of children who underwent general anaesthesia for routine elective surgery. Anaesthesia. 1988;43:981–984.
- Patel R, Lenczyck M, Hannallah RS, Mcgill WA. Age and onset of desaturation in apneic children. Can J Anaesth. 1994;41:771–774.
- Xue FS, Tong SY, Wang XL, Deng XM, An G. Study of the optimal duration of preoxygenation in children. J Clin Anesth. 1995;7:93–96.
- Hardman JG, Wills JS. The development of hypoxaemia during apnoea in children: a computational modelling investigation. Br J Anaesth. 2006;97:564–570.
- Patel R, Lenczyk M, Hannallah RS, McGill WA. Age and the onset of desaturation in apnoeic children. Can J Anaesth. 1994;41:771–774.
- Dupeyrat A, Dubreuil M, Ecoffey C. Preoxygenation in children. Anesth Analg. 1994;79:1027.
- Kinouchi K, Tanigami H, Tashiro C, Nishimura M, Fukumitsu K, Takauchi Y. Duration of apnea in anesthetized infants and children required for desaturation of hemoglobin to 95%: the influence of upper respiratory infection.Anesthesiology. 1992;77:1105–1107.
- Weiss M, Gerber AC. Rapid sequence induction in children—it’s not a matter of time! Paediatr Anaesth. 2008;18:97–99.
- Priebe HJ. Cricoid force in children. Br J Anaesth. 2010;104:511.
- Davies GA, Bolton CE. Age related changes in respiratory system. In: Fillit HM, Rockwood K, Woodhouse KW, eds. Philadelphia, PA: Saunders Elsevier. Brockhurst’s Text Book of Geriatric Medicine and Gerontology, 7th ed. 2010:97–100.
- Wahba WM. Influence of aging on lung function—clinical significance of changes from age twenty. Anesth Analg. 1983;62:764–776.
- McCarthy G, Elliott P, Mirakhur RK, McLoughlin C. A comparison of different pre-oxygenation techniques in the elderly. Anaesthesia. 1991;46:824–827.
- Valentine SJ, Marjot R, Monk CR. Preoxygenation in the elderly: a comparison of the four-maximal-breath and three-minute techniques. Anesth Analg. 1990;71:516–519.
- Tarhan S, Moffit EA, Sessler A, Douglas WW, Taylor WF. Risk of anesthesia and surgery in patients with chronic bronchitis and chronic obstructive pulmonary disease. Br J Anaesth. 1973;74:720–726.
- Gunnarsson L, Tokics L, Lundquist H, et al. Chronic obstructive pulmonary disease and anaesthesia: formation of atelectasis and gas exchange impairment. Eur Respir J. 1991;4:1106–1116.
- Samain E, Biard M, Farah E, Holtzer S, Delefosse D, Marty J. Monitoring expired oxygen fraction in preoxygenation of patients with chronic obstructive pulmonary disease. Ann Fr Anesth Reanim. 2002;21:14–19.
- Leissner KB, Mahmood FU. Physiology and pathophysiology at high altitude: considerations for the anesthesiologist. J Anesth. 2009;23:543–553.
- Baraka A, Salem MR, Joseph NJ. Critical hemoglobin desaturation can be delayed by apneic diffusion oxygenation.Anesthesiology. 1999;90:332–333.
- Frumin MJ, Epstein RM, Cohen G. Apneic oxygenation in man. Anesthesiology. 1959;20:789–798.
- Ramachandran SK, Cosnowski A, Shanks A, Turner CR. Apneic oxygenation during prolonged laryngoscopy in obese patients: a randomized, controlled trial of nasal oxygen administration. J Clin Anesth. 2010;22:164–168.
- Teller LE, Alexander CM, Frumin MJ, Gross JB. Pharyngeal insufflation of oxygen prevents arterial desaturation during apnea. Anesthesiology. 1988;69:980–982.
- Eger EI, Severinghaus JW. The rate of rise of PaCO2 in the apneic anesthetized patient. Anesthesiology. 1961;22:419–425.
- Fraioli RL, Sheffer LA, Steffenson JL. Pulmonary and cardiovascular effects of apneic oxygenation in man.Anesthesiology. 1973;39:588–596.
- McNamara MJ, Hardman JG. Hypoxaemia during open-airway apnoea: a computational modelling analysis.Anaesthesia. 2005;60:741–746.
- Cressey DM, Berthoud MC, Reilly CS. Effectiveness of continuous positive airway pressure to enhance pre-oxygenation in morbidly obese women. Anaesthesia. 2001;56:680–684.
- Rusca M, Proietti S, Schnyder P, et al. Prevention of atelectasis formation during induction of general anesthesia. Anesth Analg. 2003;97:1835–1839.
- Herriger A, Frascarolo P, Spahn DR, Magnusson L. The effect of positive airway pressure during pre-oxygenation and induction of anaesthesia upon duration of non-hypoxic apnoea. Anaesthesia. 2004;59:243–247.
- El-Khatib MF, Kanazi G, Baraka AS. Noninvasive bilevel positive airway pressure for preoxygenation of the critically ill morbidly obese patient. Can J Anaesth. 2007;54:744–747.
- Joris JL, Sottiaux TM, Chiche JD, Desaive CJ, Lamy ML. Effect of bi-level positive airway pressure (BiPAP) nasal ventilation on the postoperative pulmonary restrictive syndrome in obese patients undergoing gastroplasty. Chest. 1997;111:665–670.
- Patel A, Nourae SA. Transnasal humidified rapid-insufflation ventilatory exchange (THRIVE): a physiological method of increasing apnoea time in patients with difficult airways. Anaesthesia. 2015;70:323–329.
- Ritchie JE, Williams AB, Gerard C, Hockey H. Evaluation of a humidified nasal high-flow oxygen system, using oxygraphy, capnography and measurement of upper airway pressures. Anaesth Intensive Care. 2011;39:1103–1110.
- Howells TH, Riethmuller RJ. Signs of endotracheal intubation. Anaesthesia. 1980;35:984–986.
- McShane AJ, Martin JL. Preoxygenation and pulse oximetry may delay detection of esophageal intubation. J Natl Med Assoc. 1987;79:987, 991–992.
- Salem MR, Baraka A. Confirmation of tracheal intubation. In: Hagberg CA, ed. Benumof and Hagberg’s Airway Management. 2nd ed. Philadelphia, PA: Mosby Elsevier. 2007;697–216.
- Gunnarsson L, Tokics L, Gustavsson H, Hedenstierna G. Influence of age on atelectasis formation and gas exchange impairment during general anaesthesia. Br J Anaesth. 1991;66:423–432.
- Lundquist H, Hedenstierna G, Strandberg A, Tokics L, Brismar B. CT-assessment of dependent lung densities in man during general anaesthesia. Acta Radiol. 1995;36:626–632.
- Joyce CJ, Baker AB. What is the role of absorption atelectasis in the genesis of perioperative pulmonary collapse? Anaesth Intensive Care. 1995;23:691–696.
- Nunn JF, Williams IP, Jones JG, Hewlett AM, Hulands GH, Minty BD. Detection and reversal of pulmonary absorption collapse. Br J Anaesth. 1978;50:91–100.
- Lumb AB, Pearl RG. Anaesthesia. In: Lumb AB, ed. Nunn’s Applied Respiratory Physiology, 7th ed. Philadelphia, PA: Churchill Livingstone Elsevier. 2010;327–354.
- Hedenstierna G, Edmark L. Mechanisms of atelectasis in the perioperative period. Best Pract Res Clin Anaesthesiol. 2010;24:157–169.
- Joyce CJ, Williams AB. Kinetics of absorption atelectasis during anesthesia: a mathematical model. J Appl Physiol (1985). 1999;86:1116–1125.
- Rothen HU, Sporre B, Engberg G, Wegenius G, Reber A, Hedenstierna G. Prevention of atelectasis during general anaesthesia. Lancet. 1995;345:1387–1391.
- Edmark L, Kostova-Aherdan K, Enlund M, Hedenstierna G. Optimal oxygen concentration during induction of general anesthesia. Anesthesiology. 2003;98:28–33.
- Benoît Z, Wicky S, Fischer JF, et al. The effect of increased FIO(2) before tracheal extubation on postoperative atelectasis. Anesth Analg. 2002;95:1777–1781.
- Rothen HU, Neumann P, Berglund JE, Valtysson J, Magnusson A, Hedenstierna G. Dynamics of re-expansion of atelectasis during general anaesthesia. Br J Anaesth. 1999;82:551–556.
- Jamieson D, Chance B, Cadenas E, Boveris A. The relation of free radical production to hyperoxia. Annu Rev Physiol. 1986;48:703–719.
- Turrens JF, Freeman BA, Levitt JG, Crapo JD. The effect of hyperoxia on superoxide production by lung submitochondrial particles. Arch Biochem Biophys. 1982;217:401–410.
- Turrens JF, Freeman BA, Crapo JD. Hyperoxia increases H2O2 release by lung mitochondria and microsomes.Arch Biochem Biophys. 1982;217:411–421.
- Chandel NS, Budinger GR. The cellular basis for diverse responses to oxygen. Free Radic Biol Med. 2007;42:165–174.
- Crystal GJ, Malik G, Yoon SH, Kim SJ. Isoflurane late preconditioning against myocardial stunning is associated with enhanced antioxidant defenses. Acta Anaesthesiol Scand. 2012;56:39–47.
- Jenkinson SG. Oxygen toxicity. New Horiz. 1993;1:504–511.
- Lumb AB, Walton LJ. Perioperative oxygen toxicity. Anesthesiol Clin. 2012;30:591–605.
- Lumb AB. Just a little oxygen to breathe as you go off to sleep…is it always a good idea? Br J Anaesth. 2007;99:769–771.
- Eggers J, Paley HW, Leonard JJ, Warren JV. Hemodynamic responses to oxygen breathing in man. J Appl Physiol. 1962;17:75–79.
- Daly WJ, Bondurant S. Effects of oxygen breathing on the heart rate, blood pressure, and cardiac index of normal men—resting, with reactive hyperemia, and after atropine. J Clin Invest. 1962;41:126–132.
- Ganz W, Donoso R, Marcus H, Swan HJ. Coronary hemodynamics and myocardial oxygen metabolism during oxygen breathing in patients with and without coronary artery disease. Circulation. 1972;45:763–768.
- Neill WA. Effects of arterial hypoxemia and hyperoxia on oxygen availability for myocardial metabolism. Patients with and without coronary heart disease. Am J Cardiol. 1969;24:166–171.
- Bourassa MG, Campeau L, Bois MA, Rico O. The effects of inhalation of 100 percent oxygen on myocardial lactate metabolism in coronary heart disease. Am J Cardiol. 1969;24:172–177.
- McNulty PH, King N, Scott S, et al. Effects of supplemental oxygen administration on coronary blood flow in patients undergoing cardiac catheterization. Am J Physiol Heart Circ Physiol. 2005;288:H1057–H1062.
- Farquhar H, Weatherall M, Wijesinghe M, et al. Systematic review of studies of the effect of hyperoxia on coronary blood flow. Am Heart J. 2009;158:371–377.
- Rubanyi GM, Vanhoutte PM. Superoxide anions and hyperoxia inactivate endothelium-derived relaxing factor. Am J Physiol. 1986;250:H822–H827.
- Mouren S, Souktani R, Beaussier M, et al. Mechanisms of coronary vasoconstriction induced by high arterial oxygen tension. Am J Physiol. 1997;272:H67–H75.
- Bergofsky EH, Bertun P. Response of regional circulations to hyperoxia. J Appl Physiol. 1966;21:567–572.
- Purves MJ. Regulation of cerebral vessels by oxygen. The Physiology of the Cerebral Circulation. Cambridge, UK: Cambridge University Press; 1972:232–252.
- Xu F, Liu P, Pascual JM, Xiao G, Lu H. Effect of hypoxia and hyperoxia on cerebral blood flow, blood oxygenation, and oxidative metabolism. J Cereb Blood Flow Metab. 2012;32:1909–1918.
- Lambertsen CJ, Dough RH, Cooper DY, Emmel GL, Loeschcke HH, Schmidt CF. Oxygen toxicity; effects in man of oxygen inhalation at 1 and 3.5 atmospheres upon blood gas transport, cerebral circulation and cerebral metabolism. J Appl Physiol. 1953;5:471–486.
- Kainuma M, Kimura N, Shimada Y. Effect of acute changes in renal arterial blood flow on urine oxygen tension in dogs. Crit Care Med. 1990;18:309–312.
- Flemming B, Seeliger E, Wronski T, Steer K, Arenz N, Persson PB. Oxygen and renal hemodynamics in the conscious rat. J Am Soc Nephrol. 2000;11:18–24.




