- Cơ chế của sự hình thành huyết khối
- Sinh lý của quá trình đông máu
Đông máu bao gồm một giai đoạn khởi đầu là giai đoạn tiểu cầu bám dính nội mạc mạch máu và một giai đoạn thứ 2 gọi là hình thành cục máu đông.
- Giai đoạn đầu của quá trình đông máu
Bình thường ở trạng thái không hoạt hóa tiểu cầu di chuyển tự do trong lòng mạch. Khi nội mạc mạch máu bị tổn thương tiểu cầu sẽ di chuyển đến và bám dính vào chỗ tổn thương, đồng thời giải phóng ra các chất trung gian co mạch và các chất hóa hướng động bạch cầu. Sau đó tiểu cầu sẽ bị phân hủy và tập trung các tiểu cầu khác tới hình thành nên sự ngưng kết tiểu cầu.
Sự kết dính tiểu cầu có vai trò của lớp nội mô và dưới nội mô, các thụ thể của màng tiểu cầu và một số glycoprotein huyết tương. Khi nội mạc mạch máu bị tổn thương nó bộc lộ lớp collagene dưới nội mạc và tiểu cầu dính vào lớp collagen này nhờ phức hợp glycoprotein GP Ia/IIa và dính vào fibronectine nhờ glycoprotein GP Ic/IIa.
Sau khi kết dính, các tiểu cầu trải rộng ra bề mặt bị tổn thương. Lúc này tiểu cầu được hoạt hóa bởi các yếu tố ngoại sinh như là collagene hoặc thrombine. Khi tiểu cầu hoạt hóa sẽ giải phóng các thành phần trong hạt tiểu cầu: các hạt đặc chứa ADP và serotonin, các hạt alpha chứa fibrinogen, fibronectine, yếu tố vWF(von Willebrand factor) và yếu tố tăng trưởng có nguồn gốc tiểu cầu(PDGF).
Sau khi hoạt hóa nồng độ calci trong tiểu cầu tăng và do đó yếu tố tiểu cầu GP IIb/IIIa bị hoạt hóa. Dưới tác động của yếu tố này, các tiểu cầu tiến lại gần nhau và dính vào nhau thành từng lớp và giữa các lớp là fibrinogen và vWF. Cùng trong thời gian này, acid arachidonic được giải phóng từ vỏ tiểu cầu và được chuyển dạng bởi oxyclooxygenase thành endoperoxydase. Thromboxan synthetase tác động vào một trong các endoperoxydase này để tạo nên thromboxan A2.
Thromboxan A2 chuyển vận dòng calci trong tiểu cầu và tham gia hoạt hóa thụ thể GP IIb/IIIa. Đây là một yếu tốt làm gia tăng phản ứng co mạch.
Sự kết dính của tiểu cầu bị ức chế bởi một prostaglandine dẫn xuất từ acid arachidonic và từ sự tổng hợp của thành mạch:prostaglandine là một chất giãn mạch.
- Đông máu thứ phát hay sự hình thành cục máu đông
Sự hình thành cục máu đông làm cho huyết khối chắc lại do sự chuyển fibrinogen dễ tan thành fibrinogen không hòa tan hay fibrin.
Quá trình đông máu bị chi phối bởi hàng loạt yếu tố mà phần lớn các yếu tố này được tổng hợp từ gan. Nó được gọi theo tên hay theo số tương ứng với danh pháp quốc tế. Các yếu tố này thuộc 2 nhóm:
- Các enzym hay tiền enzym được tổng hợp phần lớn từ gan. Tất cả enzym này trừ yếu tố XIIa, thuộc nhóm serin protease. Bốn yếu tố II, VII, IX, X cần phải có vitamin K để tổng hợp chúng từ gan.
- Các yếu tố thúc đẩy phản ứng enzym bao gồm:
- Proaccelerine(yếu tố V) tổng hợp từ gan.
- Yếu tố chống hemophiline A(yếu tố VIII).
- Kininogene có trọng lượng phân tử cao đóng vai trò bề mặt của quá trình hình thành cục máu đông.
Quá trình hình thành cục máu đông tiến triển theo 2 con đường: con đường ngoại sinh và con đường nội sinh.
Bảng 1: Các yếu tố đông máu
- Con đường ngoại sinh: là con đường được triển khai nhanh chóng trong thời gian vài giây. Yếu tố VII(proconvertine) tự gắn vào phần phospholipide của thromboplastine tế bào khi có mặt của calci. Khi đã hoạt hóa, yếu tố VII tác động vào yếu tố X (Stuart). Yếu tố X đã hoạt hóa(Xa) khi có mặt của yếu tố V(proaccelerine) cắt prothrombine(yếu tố II) thành nhiều mảnh gọi là thrombine.
- Con đường nội sinh: triển khai chậm hơn. Điểm khởi phát của con đường này là các bề mặt không phải nội mạc mạch máu(dưới nội mô, mảng vữa xơ, bề mặt nhân tạo) và có vai trò của 4 yếu tố: yếu tố XII(yếu tố Hageman), kininogen trọng lượng phân tử cao, prekallicreine, yếu tố XI(plasma thromboplastine antecedent). Yếu tố XI hoạt hóa sẽ tác động vào yếu tố IX (yếu tố chống đông hemophilie B). yếu tố IX sau khi được hoạt hóa sẽ gắn vào một phospholipide để tạo thành một phức hợp với yếu tố VIII(yếu tố chống hemophilie A). Phức hợp này sẽ hoạt hóa yếu tố X lúc đó cũng gắn vào phospholipid này của tiểu cầu. Hai con đường nội sinh và ngoại sinh lúc này kết hợp với nhau: yếu tố Xa khi có mặt của yếu tố V sẽ cắt prothrombine thành thrombine.
Sự hình thành fibrine là một giai đoạn nhanh nhất của quá trình hình thành cục máu đông. Thrombine cắt các peptid A và B ở vị trí đầu của chuỗi A alpha và A beta của fibrinogen và biến đổi liên kết monomer một cách tự phát thành polymer. Sự ổn định của fibrin cần phải có sự tác động của yếu tố XIII(yếu tố ổn định fibrin) hoạt hóa bởi fibrin khi có mặt của calci. Fibrin tạo thành một mạng lưới vây các hồng cầu trong khu vực này: đó là huyết khối đỏ. Sự co cục máu trong cơ thể cho phép củng cố vững chắc quá trình đông máu. Co cục máu này là do các tiểu cầu cố định trên mạng lưới fibrin co lại.
- Có sự tồn tại của các chất ức chế sự hình thành cục máu đông?
Quan trọng nhất là antithrombine III do gan tổng hợp và được gọi là đồng yếu tố của heparin. Protein C là một yếu tố ức chế sinh lý sự hình thành cục máu đông phụ thuộc vitamin K. Protein C được hoạt hóa bởi thrombin khi có mặt của thrombomoduline nội mạc và một yếu tố phụ thuộc vitamin K huyết tương khác nữa đó là protein S. Protein C bất hoạt yếu tố Va và yếu tố VIIIa.
Protein C hoạt hóa bổ thể bị bất hoạt bởi yếu tố bất hoạt plasminogen type I(PAI-1).
Hệ thống đại thực bào đặc biệt của gan ngăn ngừa sự lan rộng của cục máu đông bằng cách phá hủy các phân tử hoạt hóa lưu hành trong tuần hoàn.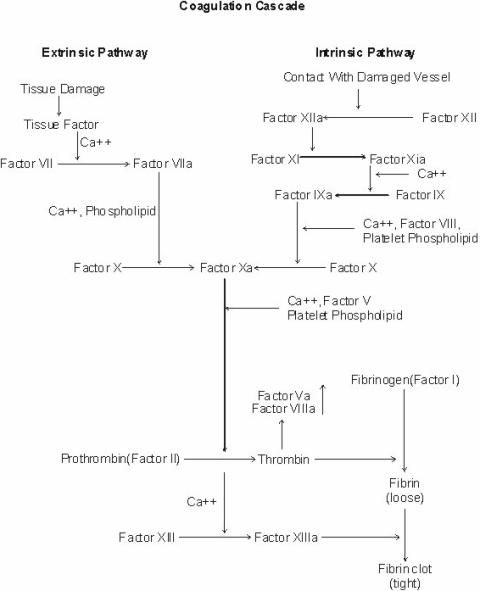
Bảng 2: Sơ đồ đông máu
- Tiêu sợi huyết
Quá trình tiêu sợi huyết cho phép hòa tan cục máu đông. Nó thực hiện nhờ sự hoạt hóa plasminogene thành plasmine một chất tiêu hủy protein chủ yếu của hệ thống tiểu fibrin
Plasminogen là một glycoprotein được tổng hợp từ gan. Đời sống bán hủy của nó là 48h. Plasminogen có thể gắn vào được fibrin, sự hoạt hóa plasminogen được thực hiện theo con đường nội sinh và ngoại sinh.
Con đường ngoại sinh được phát động bởi tPA. Đó là một sản phẩm hoạt hóa sinh lý của tế bào nội mạc. Tỷ lệ tPA giảm đi ở người có tuổi và 3 tháng cuối của thai kỳ, tăng lên sau ứ trệ tĩnh mạch, hoạt động thể lực và can thiệp phẫu thuật.
Con đường nội sinh phụ thuộc vào yếu tố XII và được thực hiện thông qua một protein trung gian có tên là đồng yếu tố của yếu tố Hagemann.
Con đường nội sinh cũng có thể được hoạt hóa bởi prourokinase, tiền chất của urokinase hình thành từ chuỗi phân hủy fibrin.
Plasmine bao gồm 2 chuỗi, một chuỗi nặng(60000 dalton) và một chuỗi nhẹ(25000 dalton). Nó tự tấn công không những fibrin mà còn cả fibrinogen và các yếu tố V, VII, XII, XIII của quá trình hình thành cục máu đông.
Plasmine có thể hoạt hóa các tiểu cầu và đây là cơ sở cho điều trị phối hợp bằng các chất chống ngưng kết tiểu cầu khi sử dụng trị liêu tiêu sợi huyết để ngăn ngừa hiện tượng tái tắc nghẽn.
- Sinh lý bệnh của sự hình thành huyết khối
Huyết khối là một quá trình dẫn đến sự hình thành cục máu đông trong cơ thể. Ba yếu tố đóng vai trò xác định trong cơ chế bệnh sinh của nó.
- Yếu tố thành mạch: sự không toàn vẹn của lớp nội mô
Từ các thương tổn có bản chất tự nhiên khác nhau(chấn thương, viêm, dị ứng, nhiễm độc, do nguyên nhân dinh dưỡng), các thương tổn nội mạc giải phóng ra thromboplastin tổ chức. Dưới tác động của 3 yếu tố huyết tương: yếu tố VII, yếu tố X, yếu tố V, thromboplastine tổ chức chuyển thành prothrombinase(tức thromboplastine hoạt hóa). Các tiểu cầu sẽ cố định trên các mép vết thương để tạo thành cục huyết khối trắng(nút tiểu cầu), tiếp theo là cục tắc có thành phần fibrin-máu hay huyết khối đỏ.
Do vậy, vết loét của lớp nội mạc động mạch do các mảng vữa xơ có thể khởi phát một hệ thống hình thành cục máu đông ngoại sinh gây ra huyết khối động mạch.
- Yếu tố máu
Máu tăng đông có thể do tăng thời gian hình thành thromboplastine ngoại sinh, do suy giảm cơ chế ức chế, nhất là antithrombine, do rối loạn fibrinogen.
Đa hồng cầu, tăng tiểu cầu, rối loạn chuyển hóa lipid cũng là các yếu tố thuận lợi cho sự hình thành huyết khối.
- Yếu tố huyết động
Tốc độ tuần hoàn chậm là một yếu tố chủ yếu trong sự hình thành huyết khối tĩnh mạch
Thực tế các yếu tố không gây tác động riêng rẽ mà chắc chắn, nó tương tác ở những mức độ khác nhau, các yếu tố thành mạch và tiểu cầu đóng vai trò chủ yếu trong nguyên nhân của huyết khối động mạch, tốc độ tuần hoàn chậm và rối loạn trong môi trường tuần hoàn lại là nguyên nhân chủ yếu của huyết khối tĩnh mạch.
- Sự bảo vệ sinh lý chống lại huyết khối
Cơ thể có những công cụ để chống lại hiện tượng đông máu nội mạch:
- Prostaglandin(PGI2): được tổng hợp bởi thành mạch bình thường, chống lại hiện tượng kết dính tiểu cầu, nó phân tán các tiểu cầu đã kết dính lại.
- Dòng chảy của máu tuần hoàn cuốn đi và làm phân tán các đám tiểu cầu. Nó hòa tan thrombine ở bề mặt huyết khối
- Gan và hệ thống liên võng nội mạc, một mặt sản xuất ra các chất ức chế tự nhiên(đặc biệt là antithrombin) mặt khác phá hủy và trung hòa các yếu tố đông máu hoạt hóa.
- Sự tiêu thụ fibrin sinh lý làm hòa tan các mảnh fibrin.
- Các loại thuốc chống đông
- Các loại thuốc chống đông thật sự : heparin và các thuốc liên quan, kháng vitamin k. Là những thuốc cản trở quá trình hình thành cục máu đông.
- Thuốc chống kết tập tiểu cầu : aspirin, dypiridamol, ticlopidine, ức chế thụ thể GPIIb/IIIa … cản trở tiểu cầu kết tập để hình thành cục máu đông.
- Thuốc tiêu huyết khối : streptokinase, urokinase, t-pA … làm tăng nhanh quá trình tan cục máu đông.
- Những chất chống đông thế hệ mới : ức chế trực tiếp thrombin, yếu tố Xa, IXa, VIIa cũng như bất hoạt VIIIa và Va bằng cách gia tăng chống đông của protein C. Ngoại trừ ức chế trực tiếp thrombin, hầu hết những chất chống đông này vẫn còn đang thí nghiệm giai đoạn 3.
- Ức chế thrombin : hirudin, bivalirudin, argatroban, ximelagatran.
- Ức chế Xa : TAP (tick anticoagulant peptide), antistalin, lefaxin.
- Heparin
- UFH: Heparin không phân đoạn
- Là mucopolysaccharide, trọng lượng phân tử 3.000 – 30.000 dalton, có ở bền mặt tiểu cầu, mastocyst.
- Heparin trên thị trường được chiết xuất từ niêm mạc ruột heo, bò, bị phân hủy trong hệ tiêu hóa nên chỉ dùng dạng tiêm.
- Biệt dược :
- Natriheparin : heparin lọ 5ml = 25.000 UI.
- Calciheparin : calciparin 1ml = 25.000 UI.
- Dược động học : tiêm dưới da thuốc hấp thu từ từ nên tác dụng kéo dài. Tiêm tĩnh mạch nồng độ thuốc tăng cao trong máu nhanh. Độ khả dụng sinh học sau tiêm 30%.
- Chuyển hóa ở gan (men heparinase). Liều thấp được loại thải chủ yếu trong đại thực bào và tế bào nội mô, liều cao thải thêm ở thận.
- Không qua được màng bụng, màng phổi, màng não, nhau thai, không vào sữa.
- Thời gian bán hủy tùy thuộc liều dùng : 30 phút – 2 giờ, kéo dài khi có suy gan, suy thận.
- Cơ chế tác dụng : tác động thông qua antithrombin III (ATIII), là protein huyết tương ức chế đông máu thông qua ức chế IXa, Xa, XIa và thrombin (II). ATIII tăng tác dụng 1.000 lần sau khi kết hợp với heparin. Heparin liên kết với ATIII và cả thrombin làm bất hoạt thrombin (tác dung kháng IIa). Phức hợp heparin + ATIII còn làm bất hoạt Xa (tác dụng kháng Xa) (tỉ lệ chống Xa/IIa = 1).
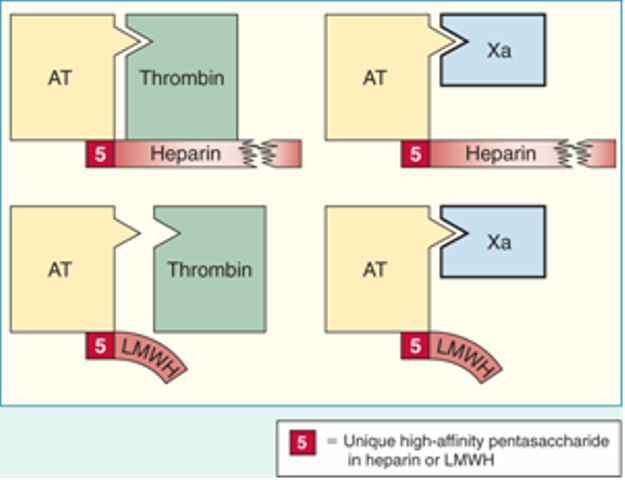
Cơ chế tác dụng UFH [1]
- Liều dùng – cách dùng – theo dõi
+ Liều cao : ngăn sự lan rộng huyết khối đã hình thành, cần theo dõi bằng xét nghiệm đông máu.
Điều trị thuyên tắc tĩnh mạch sâu (DVT) hoặc thuyên tắc phổi (PE) : tiêm tĩnh mạch bolus 80 UI/kg + truyền liên tục 18 UI/kg/giờ để aPTT 1,5 – 2,5 lần chứng hoặc nồng độ heparin 0,3 – 0,7 UI/ml.
Nhồi máu cơ tim có ST chênh (STEMI) bolus 60 UI/kg (tối đa 4.000 UI) + truyền liên tục 12 UI/kg/giờ (tối đa 1.000 UI/giờ), để aPTT 1,5 – 2 lần chứng (50 – 70 giây).
NSTEMI (non STEMI) : 60 – 70 UI/kg bolus (tối đa 5.000 UI) + truyền liên tục 12 – 15 UI/giờ
+ Theo dõi :
Kiểm tra aPTT (TCK) 6 giờ sau khi tiêm bolus heparin, tùy kết quả aPTT điều chỉnh vận tốc trong suốt điều trị, kiểm tra aPTT định kỳ mỗi 6 – 12 giờ.
aPTT chỉ nhạy với nồng độ heparin 0,1 – 1 UI/ml, nếu nồng độ heparin lớn hơn 1UI/ml aPTT không dài hơn, do vậy khi dùng heparin liều cao (phẫu thuật tim hoặc can thiệp mạch vành qua da) aPTT không thể theo dõi được, khi đó dùng ACT.
+ Liều thấp : mục đính dự phòng huyết khối, tiêm dưới da 200UI/kg/ngày chia 2 lần không ảnh hưởng đến đông máu, nên không cần theo dõi bằng xét nghiệm chống đông.
- Điều chỉnh liều heparin dựa theo aPTT
- Tác dụng phụ và tai biến :
+ Dị ứng : tuy ít gặp nhưng có thể bị sốc.
+ Chảy máu : 5 – 25%. Do không kiểm soát chặt TCK (> 3 lần chứng), thường gặp ở người lớn tuổi (trên 60 tuổi), dùng kèm với thuốc tiêu huyết khối, thuốc đối kháng thụ thể GPIIa/IIIb, tiêm tĩnh mạch ngắt quãng. Thuốc đối kháng là protamin (1 mg protamin trung hòa 100 UI UFH).
+ Giảm tiểu cầu (HIT).
+ Lâu dài : rụng tóc, loãng xương.
- Chống chỉ định dùng heparin :
+ Tạng chảy máu nặng.
+ Tai biến xuất huyết não.
+ Tiền căn giảm tiểu cầu do heparin.
+ Cao huyết áp ác tính.
+ Viêm màng ngoài tim cấp.
- Lưu ý bệnh nhân đang dùng liều cao heparin không được tiêm bắp.
- Heparin trọng lượng phân tử thấp (LMWH)
- Là chuỗi polysaccharide nhẹ hơn được tách ra từ UFH, trọng lượng phân tử (TLPT) 2.500 – 8.000 dalton
- Biệt dược :
Dalteparin : Fragmin.
Enoxaparin : Lovenox.
Nadroparin : Fraxiparin.
- Dược động học : TLPT thấp ít bám vào tế bào nội mạc thành mạch, độ khả dụng sinh học sau tiêm dưới da > 90%. Thời gian bán hủy dài 8 – 24 giờ. Vậy nếu dùng dự phòng : tiêm 1 lần, điều trị tiêm 2 lần / ngày. Thuốc không qua được hàng rào nhau thai.
- Cơ chế : khi gắn vào AT III sẽ ức chế Xa và dự phòng được huyết khối, nhưng không liên kết được với thrombin nên không có tác dụng kháng thrombin (tỉ lệ chống Xa/chống IIa > 1).
- Tác dụng phụ
+ Vì không tác động đến II nên ít nguy cơ chảy máu, chỉ thấy ở liều cao.
+ Giảm tiểu cầu : gắn với tiểu cầu ít hơn nên nguy cơ giảm tiểu cầu thấp hơn.
+ Loãng xương ít gắn lên osteoblast nên ít gây hủy xương, ít gây loãng xương.
- Liều dùng
+ Fragmin : dự phòng tiêm dưới da 2.500 – 5.000 UI kháng Xa/ngày, điều trị : tiêm dưới da 100UI/kg/ngày chia 2 lần.
+ Lovenox : dự phòng tiêm dưới da 20 mg, điều trị : tiêm dưới da 1mg/kg mỗi 12 giờ.
- Theo dõi :
+ Vì LMWH không liên kết với thrombin nên không dùng TCK để theo dõi.
+ Thường đo nồng độ antiXa theo dõi ở bệnh nhân suy thận, béo phì, phụ nữ mang thai.
- Những thuốc khác chiết xuất từ glycosaminoglycan :
- Heparin sulfate, Dermatan sulfate, Proteoglycan : giống như phân tử heparin.
- Fondaparinux : làm bất hoạt Xa bằng AT III mà không ức chế thrombin.
- Thuốc kháng vitamin K
- Các dẫn chất 4-hydroxycoumarin : acenocoumarol (sintrom), ethylbicoumacetat (tromexane), warfarin (coumadin).
- Các dẫn chất indan-1,3dion: ít dùng do nhiều tác dụng phụ.
- Tất cả các thuốc này có cấu trúc hóa học gần giống vitamin k.
- Dược động học :
- Hấp thu gần hoàn toàn qua đường uống vài giờ sau uống, nồng độ thuốc tan trong máu cao nhất 2 – 6 giờ. Vào máu thuốc liên kết > 90% với albumin và tách ra dễ dàng. Chuyển hóa ở gan, thải ở mật, ruột. Một số thuốc thải qua thận ở dạng chuyển hóa hoặc nguyên dạng.
- Thời gian bán hủy : 2,5 giờ với ethylbicoumacetat, 42 giờ với warfarin.
- Qua được nhau thai và tiết vào sữa.
- Cơ chế :
- Vitamin k trong thức ăn (k1) và ruột (k2) được đưa đến gan. Tại đây vitamin k tham gia tổng hợp các yếu tố đông máu phụ thuộc vitamin k (II, VII, IX, X).
- Tại gan các tiền yếu tố đông máu phụ thuộc vitamin k được carboxyl hóa thành dạng có hoạt tính nhờ sự oxy hóa của vitamin k.
- Thuốc kháng vitamin k ức chế sự chuyển hóa vitamin oxy hóa thành vitamin k khử làm thiếu hụt vitamin k khử → giảm carboxyl hóa các tiền yếu tố đông máu, làm giảm các yếu tố đông máu phụ thuộc vitamin k.
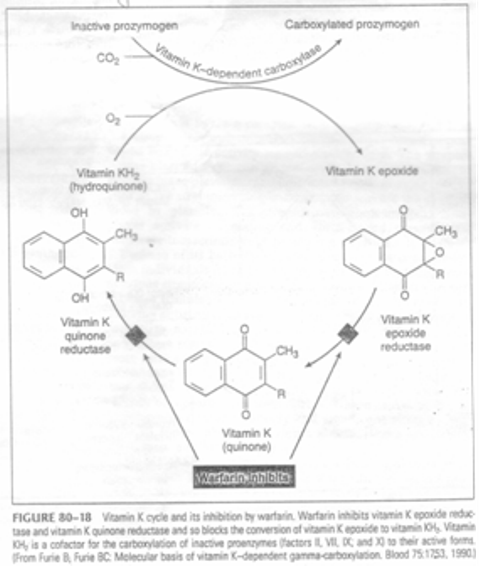
- Khi uống VKA, yếu tố VII giảm nhanh nhất (trong một ngày) do nó có thời gian bán hủy 5 – 6 giờ → ảnh hưởng TQ nhưng chưa đủ ngừa huyết khối. IX giảm trong 2 ngày. Nhưng đến ngày thứ 4 – 5 tất cả các yếu tố đông máu mới giảm đến mức cần thiết cho chống đông.
- Theo dõi điều trị.
- PT (prothrombin time hoặc TQ) : 25 – 35 %.
- aPTT (TCK) : 1,5 – 2 lần chứng.
- INR.
- Xét nghiệm nên làm sau khi uống 2 – 3 liều VKA, tiếp tục kiểm tra những ngày sau đến khi thấy liều thích hợp, sau đó 1 – 2 tuần/lần, 3 -4 tuần/lần.
- Tương tác thuốc.
- Tăng tác dụng chống đông : aspirin (non steroid), allopurinol, amiodarone, bactrim, chloramphenicol, cimetidin, clofibrate, corticoides, metronidazole, ticlopidin.
- Giảm tác dụng chống đông : barbiturates, cholestiramine, griseofulvine, rifampicine, thuốc ngừa thai, thức ăn có nhiều vitamin k.
- Chống chỉ định :
- Giống heparin.
- 3 tháng đầu (quái thai) và 3 tháng cuối thai kỳ (chảy máu).
- Suy gan nặng.
- Cách xử trí INR không nằm trong vùng điều trị:
- INR trên ngưỡng điều trị nhưng < 5, không có dấu hiệu chảy máu có ý nghĩa, đề nghị giảm hay bỏ liều, theo dõi sát và bắt đầu điều trị lại ở liều thích hợp khi INR trong vùng điều trị. Nếu cao trên ngưỡng một ít hoặc có thêm yếu tố gây thoáng thiếu máu, không cần giảm liều (1C).
- Nếu 5 ≤ INR < 9 và không chảy máu có ý nghĩa, đề nghị bỏ 1 hay 2 liều kế tiếp, theo dõi sát và điều trị lại ở liều thích hợp khi INR ở mức trị liệu (1C). Cách khác, bỏ liều và uống thêm vitamin k (1 – 2,5 mg), đặc biệt ở bệnh nhân có tăng nguy cơ gây chảy máu (2A). Nếu bệnh nhân phải phẫu thuật khẩn, đề nghị dùng vitamin k uống (≤ 5 mg) mong muốn INR sẽ giảm trong 24 giờ. Nếu INR vẫn cao,đề nghị thêm vitamin k uống 1 – 2mg (2C).
- Nếu INR > 9 ,không chảy máu có ý nghĩa, đề nghị tam ngưng warfarin và thêm liều cao vitamin k uống 2,5 – 5 mg, với hy vọng INR sẽ giảm trong 24 – 48 giờ (1B). Theo dõi INR sát hơn, thêm vitamin k nếu cần và điều trị lại ở liều thích hợp khi INR chạm ngưỡng điều trị.
- Nếu chảy máu nhiều bất kể INR tăng bao nhiêu, tạm ngưng warfarin và dùng vitamin k tĩnh mạch chậm (10 mg), thêm FFP, chế phẩm prothrombin, hoặc recombinant IIVa, tuỳ tình huống khẩn cấp. Đề nghị lập lại vitamin k mỗi 12 giờ khi INR tăng liên tục (tất cả 1C).
- Tăng INR nhẹ đến trung bình mà không chảy máu, đề nghị khi cho vitamin k nên cho đường uống (1A).
- Thuốc ức chế tiểu cầu
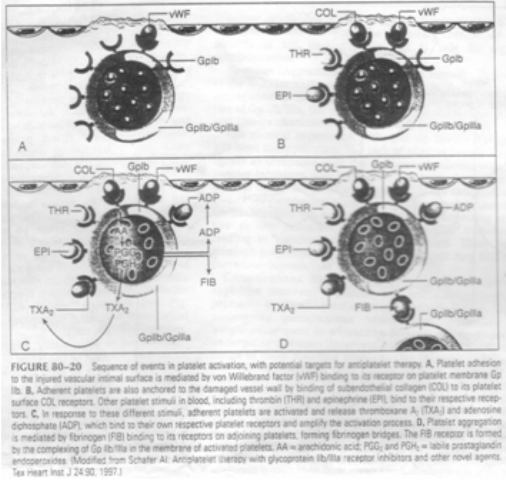
- Chuỗi sự kiện hoạt hóa tiểu cầu. A. sự kết dính tiểu cầu trên bề mặt nội mô bị tổn thương bởi yếu tố von willebrand (vWF) lên thụ thể glycoprotein IIb (GPIIb). B. tiểu cầu kết dính cũng được gắn lên nội mô bị tổn thương với collagen dưới nội mạc qua thụ thể COL trên bề mặt tiểu cầu. Mặt khác, tiểu cầu kích thích thrombin (THR), epinephrine (EPI) gắn lên thụ thể của tiểu cầu. C. các tiểu cầu kết dính cũng bị hoạt hóa phóng thích thromboxane A2 (TXA2) và adenosine diphosphate (ADP), và chúng cũng gắn lên thụ thể trên tiểu cầu làm tăng quá trình hoạt hóa. D. các tiểu cầu kết tập lại thông qua fibrinogen (FIB) và thụ thể GPIIb/IIIa trên bề mặt tiểu cầu.
- Ức chế một trong các bước hoạt hóa trên (A, B, C,D) đều có thể ức chế kết dính và kết tập tiểu cầu. Nhưng hiệu quả nhất nếu nó ức chế trực tiếp lên sự kết dính ( 82-20 A) hoặc sự kết tập (82-20D).
- Phân loại thuốc chống kết tập tiểu cầu :
- Tác động lên thụ thể màng tiểu cầu: các kháng thể kháng GPIIb/IIIa, ticlopidine, clopidogrel.
- Tác động lên chuyển hóa acid arachidonic: ức chế men cyclooxygenase (COX1, COX2) cản trở hình thành thromboxane A2: aspirin
- Tăng AMP vòng của tiểu cầu: dipyridamol
- Aspirin (acetylsalicyclic acid)
- Được biết trên 50 năm về hiệu quả chống huyết khối, an toàn, rẻ tiền trong việc ngăn chặn cục máu đông do những rối loạn mạch máu đặc biệt ở động mạch.
- Hấp thu ở dạ dày và đoạn trên ruột non nên nhanh chóng thủy phân thành acid salicylic có hoạt tính. Thải ở thận. Thời gian bán hủy 15 – 20 phút, nhưng acid salicylic 3 – 9 giờ.
- Cơ chế : aspirin ức chế enzym cyclooxygenase, làm men xúc tác của acid arachidonic thành prostagladin G2. Khi prostagladin bị ức chế sẽ ức chế tạo thromboxane A2, là chất trung gian mạnh gây kết tập tiểu cầu và co mạch
- Nghiên cứu để ức chế TXA2 tiểu cầu: uống 81 mg sẽ đạt hiệu quả tối đa 15 – 30 phút. 100 mg uống sẽ ức chế hoàn toàn tổng hợp TXA2 ở người bình thường và bệnh lý tim mạch.
- Clopidogrel
- Là dẫn chất thienopyridin, cấu trúc tương tự Ticlopidin: cũng tác dụng chống kết tập tiểu cầu.
- Hấp thụ nhanh qua đường tiêu hóa, nồng độ đỉnh/ huyết tương là 1 giờ, chuyển hóa ở gan, T ½: 8 giờ.
- Cơ chế: Ức chế hoạt hóa tiểu cầu do ADP → làm cho các thụ thể GPIIb/IIIa không được hoạt hóa → tiểu cầu không bị kết dính.
- Tác dụng phụ: RLTH, nổi mẩn, chảy máu: 0,49%, aspirin 0,7%, có thể giảm tiểu cầu: 0,1%.
- Liều: 75mg/ngày: 1 lần.
- Ticlopidin:
- Là dẫn chất thienopyridin, ức chế mạnh tiểu cầu.
- Hấp thu tốt, nhanh qua đường tiêu hóa. Nồng độ đỉnh trong huyết tương đạt sau 2 giờ.
- Chuyển hóa: gan, T ½ 30 – 50 giờ.
- Cơ chế: Tác động lên thụ thể trên tiểu cầu đối với fibrinogen phụ thuộc ADP làm cho các thụ thể giảm hoạt động, cản trở mối liên kết của tiểu cầu với Fibrinogen.
- Tác dụng phụ: tương tự Clopidogrel.
- Liều 250mg/ngày.
- Ức chế Phosphodiesterase:
- Dipyridamol.
- Cilotazol.
- Ức chế thụ thể GPIIb/IIIa:
- 3 nhóm:
- Monoclonal antibody against GPIIb/IIIa: abciximab.
- Peptid antagonist: eptifibatide (Integrilisn).
- Nonpeptid antagonist of GPIIb/IIIa: TiroFiban (Aggrastat)
- Chúng ta có thể phối hợp với Aspirin → tăng hiệu quả chống đông.
- Đã được chứng minh: dùng qua đường tĩnh mạch.
- Biến chứng:
- Chảy máu.
- Không tăng nguy cơ xuất huyết não.
- Các yếu tố nguy cơ gây thuyên tắc tĩnh mạch
Bảng các yếu tố nguy cơ VTE
Strong risk factors (odds ratio10)
Fracture (hip or leg)
Hip or knee replacement
Major general surgery
Major trauma
Spinal cord injury
Moderate risk factors (odds ratio 2–9)
Arthroscopic knee surgery
Central venous lines
Chemotherapy
Congestive heart or respiratory failure
Hormone replacement therapy
Malignancy
Oral contraceptive therapy
Paralytic stroke
Pregnancy/, postpartum
Previous venous thromboembolism
Thrombophilia
Weak risk factors (odds ratio < 2)
Bed rest3 days
Immobility due to sitting (e.g. prolonged car or air travel)
Increasing age
Laparoscopic surgery (e.g. cholecystectomy)
Obesity
Pregnancy/, antepartum
Các yếu tố nguy cơ thuyết phục được chứng minh gây VTE: lớn tuổi, bất động kéo dài, bệnh lý ác tính, phẫu thuật lớn, đa chấn thương, trước đây bị VTE, suy tim mãn.
Các phẫu thuật lớn: Định nghĩa
- Các PT ngực hay bụng cần phải gây mê >= 30 phút.
- Các PT có nguy cơ cao VTE: CABG, PT bệnh lý phụ khoa ác tính, các PT lớn về niệu khoa, sau PT thần kinh nhưng loại trừ PT trong sọ( chống chỉ định tương đối sử dụng kháng đông).
| TABLE 2. Risk Factors Observed in 1231 Consecutive Patients Treated for Acute DVT and/or PE | |
| Risk Factor | Patients (%) |
| Age40 years | 88.5 |
| Obesity | 37.8 |
| History of venous thromboembolism | 26.0 |
| Cancer | 22.3 |
| Bed rest5 days | 12.0 |
| Major surgery | 11.2 |
| Congestive heart failure | 8.2 |
| Varicose veins | 5.8 |
| Fracture (hip or leg) | 3.7 |
| Estrogen treatment | 2.0 |
| Stroke | 1.8 |
| Multiple trauma | 1.1 |
| Childbirth | 1.1 |
| Myocardial infarction | 0.7 |
| 1 or more risks | 96.3 |
| 2 or more risks | 76.0 |
| 3 or more risks | 39.0 |
- Chọn bệnh nhân để dự phòng nguy cơ thuyên tắc tĩnh mạch:
- Có đủ chứng cớ đề nghị điều trị dự phòng thường qui cho một số nhóm bệnh nhân: PT lớn, PT niệu, PT phụ khoa, PT thần kinh, PT điều trị gãy khớp háng, PT thay khớp chi dưới, chấn thương lớn hoặc tổn thương tủy, hầu hết bệnh nhân NMCT cấp, ung thư, suy tim, suy hô hấp, đột quỵ do thiếu máu, bệnh phổi nặng.
- Các thuốc điều trị dự phòng VTE: LMWH, warfarin, liều thấp UFH, intermittent pneumatic compression. Các bệnh nhân có nguy cơ cao chảy máu nên được bắt đầu bằng biện pháp cơ học( intermittent pneumatic compression/ vớ đàn hồi) cho đến khi nguy cơ chảy máu giảm.
- Bệnh nhân có một nguy cơ yếu hoặc trung bình (bảng 1): không cần điều trị dự phòng, mặt khác bệnh nhân có nhiều yếu tố nguy cơ nên điều trị dự phòng trừ khi có chống chỉ định.
- Nguy cơ đột quỵ trong rung nhĩ và điều trị chống đông:
- Dựa trên thang điểm CHADS2
| Condition | Points | |
| C | Congestive heart failure | 1 |
| H | Hypertension | 1 |
| A | Age > 75 years | 1 |
| D | Diabetes Mellitus | 1 |
| S2 | Prior Stroke or TIA | 2 |
- Anticoagulation based on the CHADS2 score
| Score | Risk | Anticoagulation Therapy | Considerations |
| 0 | Low | Aspirin | Aspirin daily |
| 1 | Moderate | Aspirin or Warfarin | Aspirin daily or raise INR to 2.0-3.0, depending on factors such as patient preference |
| 2 or greater | Moderate or High | Warfarin | Raise INR to 2.0-3.0, unless contraindicated (e.g. clinically significant GI bleeding, inability to obtain regular INR screening) |
- Annual Stroke Risk with Respect to CHADS 2 Score
| CHADS2 Score | Stroke Risk % | 95% confidence interval |
| 0 | 1.9 | 1.2-3.0 |
| 1 | 2.8 | 2.0-3.8 |
| 2 | 4.0 | 3.1-5.1 |
| 3 | 5.9 | 4.6-7.3 |
| 4 | 8.5 | 6.3-11.1 |
| 5 | 12.5 | 8.2-17.5 |
| 6 | 18.2 | 10.5-27.4 |
- Nguyên tắc chung điều trị chống đông chu phẫu
- Đánh giá nguy cơ thuyên tắc do huyết khối khi ngưng điều trị chống huyết khối
- Khi ngưng điều trị thuốc chống huyết khối sẽ làm tăng nguy cơ thuyên tắc do huyết khối như: đột quỵ, huyết khối van cơ học, với nguy cơ thay đổi tùy thuộc vào chỉ định điều trị thuốc chống huyết khối và sự hiện diện của tình trạng bệnh phối hợp. Chúng để lại những di chứng nặng nề: đột quỵ, tàn phế hoặc tử vong đến 70%; huyết khối van cơ học gây tử vong 15%; thiếu máu cơ tim chu phẫu làm tăng gấp 2-4 lần nguy cơ tử vong.Tương tự, ngưng thuốc chống tiểu cầu trên bệnh nhân đặt stent mạch vành có phủ thuốc, đặc biệt trong vòng 6 tháng sau đặt stent, gia tăng đáng kể nguy cơ huyết khối trong stent và NMCT.
- Sự phân loại bệnh nhân theo nguy cơ huyết khối chu phẫu dựa trên chỉ định điều trị chống huyết khối và sự hiện diện của bệnh phối hợp, đã chia làm 3 nhóm: nhóm nguy cơ cao, nguy cơ trung bình, nguy cơ thấp. (Bảng 3)
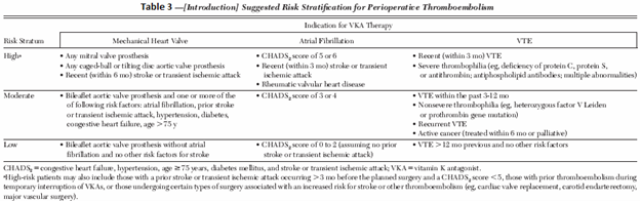
- Đánh giá nguy cơ chảy máu của phẫu thuật hoặc những thủ thuật xâm lấn.
- Khi điều trị chống huyết khối giai đoạn chu phẫu nên xem xét nguy cơ chảy máu liên quan đến phẫu thuật hoặc thủ thuật. Dù chảy máu có thể điều trị được nhưng nó để lại ảnh hưởng đáng kể trên lâm sàng. Hơn nữa, chảy máu sau phẫu thuật trì hoãn điều trị lại thuốc kháng đông, do vậy làm tăng nguy cơ thuyên tắc do huyết khối.
- Phân loại bệnh nhân có nguy cơ chảy máu chu phẫu có thể dựa trên nguy cơ chảy máu liên quan với phẫu thuật và thủ thuật và tình trạng cầm máu sau phẫu thuật.Trên những bệnh nhân này điều trị thuốc chống đông sau PT phải thận trọng, đặc biệt liều điều trị LMWH hoặc UFH khi sử dụng cầu nối kháng đông. Những PT và những thủ thuật có nguy cơ cao chảy máu chu phẫu: PT bắc cầu mạch vành, thay van tim; PT trong sọ, hoặc PT tủy sống, phình động mạch chủ, bắc cầu động mạch ngoại biên, và những PT mạch máu lớn, PT chỉnh hình như thay khớp hang, khớp gối, PT lớn về ung thư, PT bàng quang và tiền liệt tuyến.
- Hơn nữa, nên chú ý những thủ thuật trên bề mặt mặc dù có nguy cơ thấp chảy máu nhưng sử dụng kháng đông chu phẫu cũng phải thận trọng như: cắt polyp đại tràng đặc biệt các polyp không cuống>2cm, sinh thiết thận hay tuyến tiền liệt vì mô giàu mạch máu và có men urokinase nội sinh có thể làm chảy máu khi sau sinh thiết, đặt máy tạo nhịp hoặc máy phá rung phải tách các lớp cơ dưới đòn mà không có đốt điện hoặc khâu các lớp mô không đúng sẽ phát triển thành các túi hematoma.
- Cân bằng yếu tố nguy cơ thuyên tắc huyết khối và nguy cơ chảy máu:
- Những bệnh nhân được phân loại nguy cơ cao đột quỵ hay thuyên tắc do huyết khối cần phải ưu tiên ngăn chặn thuyên tắc do huyết khối như: đột quỵ do huyết khối hoặc huyết khối trong stent mạch vành nên ưu tiên điều trị kháng đông chu phẫu không quan tâm nguy cơ chảy máu vì biến chứng của nó có thể gây tử vong hoặc tàn tật vĩnh viễn hơn là biến chứng chảy máu.Tuy nhiên, nên xem xét thận trọng sử dụng cầu nối kháng đông sau PT và tối ưu hóa tình trạng đông máu trong PT.
- Những bệnh nhân được xếp nhóm nguy cơ trung bình của thuyên tắc do huyết khối, sự cần thiết để ngăn chặn huyết khối ít trội hơn nhóm nguy cơ cao và cầu nối kháng đông ít cấp thiết hơn những bệnh nhân PT nguy cơ cao chảy máu. Nhóm bệnh nhân được xếp loại nguy cơ thấp huyết khối, không cần dùng cầu nối kháng đông để ngừa thuyên tắc.
- Cách dùng kháng đông chu phẫu: sự cân nhắc trong thực hành.
- Những bệnh nhân phải trải qua PT lớn và nếu mục đích là loại bỏ ảnh hưởng của thuốc kháng đông, nên ngừng thuốc trước PT ( ngừng thuốc VKA trước 5 ngày và ngừng thuốc chống kết tập tiểu cầu trước 7-10 ngày) để loại bỏ tối đa hoặc không còn ảnh hưởng của chống đông tại thời điểm PT nhằm giảm tối đa nguy cơ chảy máu trong PT.
- Thêm các thuốc chống đông có tác dụng ngắn như: heparin trọng lượng phân tử thấp ( LMWH) hoặc heparin không phân đoạn( UFH) sau PT hay các thủ thuật xâm lấn làm tăng nguy cơ chảy máu. Nguy cơ này tùy thuộc liều thuốc chống đông và thời điểm cho trước PT( nguy cơ chảy máu cao khi dùng thuốc sát ngày PT).Trì hoãn sử dụng lại thuốc LMWH hoặc UFH( 48-72 giờ sau PT), giảm liều hoặc ngừng hoàn toàn thuốc sau PT có thể làm giảm nguy cơ chảy máu.
- Về liều thuốc kháng đông chu phẫu, mặc dù có chứng cớ cho rằng dùng liều thấp( liều dự phòng) LMWH hay UFH giúp ngăn huyết khối tĩnh mạch, nhưng thiếu chứng cứ sử dụng liều thấp ngăn ngừa huyết khối động mạch.
- Tóm tắt điều trị chống huyết khối sau PT hay các thủ thuật xâm lấn, hiệu quả warfarin sau 2-3 ngày điều trị, đối với LMWH hiệu quả chống đông cao nhất 3-5 giờ sau điều trị, ngược lại mất vài phút đạt được hiệu quả chống kết tập tiểu cầu sau khi bắt đầu aspirin và mất 3-7 ngày đạt hiệu quả đỉnh ức chế kết tập tiểu cầu sau điều trị 75mg clopidogrel.
- Đối với những PT lớn nằm viện thời gian ngắn hoặc những thủ thuật xâm lấn về trong ngày, do biến chứng liên quan chảy máu hoặc thuyên tắc huyết khối thường xảy ra khi bệnh nhân ở nhà, đặc biệt 2 tuần đầu sau thủ thuật. Vì vậy theo dõi sát bệnh nhân giai đoạn sớm sau thủ thuật để phát hiện sớm và điều trị các biến chứng.
- Cách điều trị chống huyết khối chu phẫu
- Phân độ của ACCP
GRADE I : đề nghị mạnh mẽ được đưa ra. Khi thực hiện theo đề nghị này sẽ có lợi hơn về nguy cơ, gánh nặng, giá cả.
GRADE II : độ mạch của đề nghị yếu hơn. Khi thực hiện theo đề nghị này ít chắc chắn hơn lợi ích về nguy cơ, gánh nặng, giá cả.
Để hỗ trợ cho từng đề nghị này, dùng chữ A, B, C để nói lên chất lượng cao, trung bình, thấp của chứng cớ.
- Protocol điều trị kháng đông chu phẫu được chuẩn hóa:
- Đánh giá bệnh nhân 7 ngày trước PT để lên kế hoạch điều trị kháng đông chu phẫu, đặc biệt trước PT lớn.
- Thời điểm ngưng và dùng lại warfarin và thuốc kháng tiểu cầu, liều và thời gian dùng cầu nối LMWH, đo INR.
- Đánh giá nguy cơ thuyên tắc và chảy máu của bệnh nhân.
- Đảm bảo giáo dục cho bệnh nhân và người nhà về kỹ thuật chích cầu nối kháng đông LMWH cho bệnh nhân ngoại trú.
- Kiểm tra INR trước ngày PT, nếu INR tăng có thể dùng vitamin K( 1.0-2.5mg) để tránh truyền máu hoặc trì hoãn.
- Đánh giá lại tình trạng đông cầm máu sau PT( ngày 0 và ngày 1) để an toàn sử dụng lại kháng đông sau PT.
- Lợi ích của chiến lược điều trị kháng đông chu phẫu :
Những tác dụng có lợi của của cầu nối kháng đông được đánh giá bởi nhiều nghiên cứu. Các nghiên cứu cho rằng ngoại trừ những bệnh nhân thuộc nhóm nguy cơ cao đột quỵ và thuyên tắc động mạch, dùng cầu nối kháng đông là không cần thiết.Khi phải làm các thủ thuật nhỏ về răng, các nghiên cứu cho thấy rằng uống liên tục VKA ít gây hại hơn là ngưng VKA và dùng cầu nối kháng đông.Các nghiên cứu về nội soi tiêu hóa cũng thấy rằng uống liên tục VKA ít gây hại hơn dùng cầu nối kháng đông trên bệnh nhân nguy cơ thấp chảy máu( nội soi chẩn đoán không sinh thiết), nhưng ngược lại, ngưng VKA mà không dùng cầu nối kháng đông thì gây hại nhiều hơn trên nhóm nguy cơ thấp bị thuyên tắc mà phải làm các thủ thuật có nguy cơ cao chảy máu. Các nghiên cứu thấy rằng dùng LMWH tiêm dưới da tiết kiệm tiền nhiều hơn dùng UFH truyền tĩnh mạch.
- Cách điều trị kháng đông chu phẫu trên bệnh nhân đang điều trị VKA.
- Ngưng VKA trước PT:
Ngưng thuốc VKA ở các PT hoặc các thủ thuật lớn nhằm hạn chế tối đa chảy máu chu phẫu, ngược lại ngưng VKA không cần thiết trên các thủ thuật nhỏ như đã được thảo luận ở trên. Mục đích ngưng VKA trước PT nhằm đạt được tình trạng đông máu bình thường hoặc gần bình thường tại thời điểm PT do hết tác dụng của thuốc VKA và hồi phục các yếu tố đông máu phụ thuộc vitamin k. Thời gian bán hủy của VKA: 8-11 giờ đối với acenocoumarol, 36-42 giờ đối với warfarin, 96-104 giờ đối với phenprocoumon. Vậy để đạt INR bình thường trước PT đối với warfarin( T1/2 36-42 giờ), sẽ ngưng thuốc ít nhất 5 ngày thì phần lớn hiệu quả kháng đông mới bị loại bỏ. Tuy nhiên sự phân hủy của thuốc kháng đông còn tùy thuộc từng bệnh nhân: ví dụ sự phân hủy thuốc bị trì hoãn ở bệnh nhân lớn tuổi. Chưa có nghiên cứu nào so sánh trực tiếp chảy máu chu phẫu của việc ngưng kháng đông sớm( ngưng 5 ngày trước PT) với ngưng kháng đông muộn( ngưng sau 5 ngày trước PT). Đa số nghiên cứu dựa trên INR làm đại diện và thấy rằng ngưng sớm, INR đa số về bình thường chỉ có 7% INR>1.5 tại ngày PT, ngưng muộn( 2-3 ngày trước PT) đa số INR>1.8 tại thời điểm PT. Vì thế đề nghị của chúng tôi dựa trên giả định rằng tại thời điểm PT, tăng INR( ≥2) sẽ tăng nguy cơ chảy máu và ngược lại sẽ giảm nguy cơ chảy máu( INR<1.5).
Những đề nghị:
- Khi cần ngưng VKA trước PT, đề nghị 5 ngày trước PT thay vì ngưng sát ngày PT(1C).
- Dùng lại VKA sau PT:
Đề nghị dùng lại VKA 12-24 giờ sau PT( buổi tối hoặc sáng hôm sau) và khi tình trạng đông máu đã ổn hơn là dùng lại trễ VKA(2C)
- Theo dõi xét nghiệm chu phẫu của thuốc VKA:
Xét nghiệm INR trước PT để đảm bảo INR bình thường vào ngày PT, đặc biệt trên bệnh nhân gây tê tủy sống hay gây tê ngoài màng cứng. Những chứng cớ gián tiếp cho thấy kiểm tra INR vào ngày trước PT giúp điều chỉnh gia tăng INR hạn chế sử dụng sản phẩm của máu và trì hoãn PT. Trong một nghiên cứu đoàn hệ, đo thường qui INR vào ngày trước PT, 7% bệnh nhân có INR>1.5 và được uống liều thấp vitamin k 1mg giúp cải thiện 91% bệnh nhân có INR về gần bình thường( INR≤1.4) vào ngày PT và không trì hoãn PT.
- Sự cần thiết sử dụng cầu nối kháng đông trong giai đoạn ngưng VKA
Bệnh nhân bị rung nhĩ mãn, xếp loại nguy cơ thuyên tắc dựa trên thang điểm CHADS2. Bệnh nhân có van cơ học, xếp loại nguy cơ dựa trên vị trí và loại van. Nguy cơ cao, nguy cơ trung bình, nguy cơ thấp của thuyên tắc động mạch và huyết khối van lần lượt là >10%/năm, 5-10%/năm và <5%/năm khi không có dùng kháng đông( bảng 1). Trong các nghiên cứu quan sát, bệnh nhân thuộc nhóm nguy cơ cao thuyên tắc dùng liều điều trị LMWH tiêm dưới da, có nguy cơ thuyên tắc động mạch thấp( 1%-2%). Hiếm có nghiên cứu đánh giá cầu nối kháng đông UFH tiêm tĩnh mạch trên nhóm nguy cơ cao. Huyết khối khi dùng cầu nối kháng đông UFH tiêm tĩnh mạch 0%-5%. Trong nghiên cứu đoàn hệ trên bệnh nhân có van nhân tạo, không có sự khác biệt có ý nghĩa về thuyên tắc huyết khối và chảy máu nhiều giữa 2 nhóm bệnh nhân dùng cầu nối LMWH với nhóm dùng UFH. Bảng S3 không thấy nghiên cứu đánh giá nguy cơ thuyên tắc huyết khối trong nhóm bệnh nguy cơ cao ngưng VKA và không điều trị bất cứ loại heparin nào. Trong nhóm nguy cơ trung bình dù có hay không dùng cầu nối kháng đông( liều điều trị, trung bình, và không dùng cầu nối kháng đông) tần suất thuyên tắc động mạch thấp( 1%). Bệnh nhân thuộc nhóm nguy cơ trung bình khi PT hay làm các thủ thuật nhỏ mà nguy cơ chảy máu thấp, cầu nối kháng đông có thể dùng trong trường hợp sau:
- Bệnh nhân có van cơ học 2 lá của động mạch chủ và có nguy cơ đột quỵ bao gồm: đột quỵ trước đây, thuyên tắc hệ thống, thiếu máu não thoáng qua, cao huyết áp, tiểu đường, suy tim,hoặc>75 tuổi.
- Rung nhĩ và CHADS2 3,4 điểm hoặc trước đây thuyên tắc huyết khối trong suốt giai đoạn ngưng warfarin.
- Bệnh nhân bị thuyên tắc tĩnh mạch trong 3-12 tháng qua, ung thư, VTE tái phát.
Bệnh nhân thuộc nhóm nguy cơ trung bình nhưng phải PT có nguy cơ cao chảy máu, có thể không dùng cầu nối kháng đông:
- Phẫu thuật lớn về tim
- PT bóc tách động mạch cảnh.
Một nghiên cứu tiền cứu đánh giá không dùng cầu nối kháng đông trên bệnh nhân nhóm nguy cơ thấp có van động mạch chủ cơ học 2 đĩa và không có yếu tố nguy cơ tim mạch lớn khác đi kèm, tỉ lệ ATE trong nhóm bệnh nhân này rất thấp(<1%), do vậy không không dùng cầu nối kháng đông trên nhóm bệnh nhân này.
- Bệnh nhân có van tim cơ học, rung nhĩ, hoặc VTE ở nhóm nguy cơ cao thuyên tắc huyết khối, nên dùng cầu nối kháng đông hơn là không dùng trong suốt giai đoạn ngưng VKA( 2C).
Nhóm bệnh nhân trên thuộc nguy cơ trung bình thuyên tắc huyết khối việc chọn lựa dùng hay không dùng cầu nối kháng đông dựa trên đánh giá từng bệnh nhân và các yếu tố liên quan PT.
- Cách thức chu phẫu của các bênh nhân được điều trị thuốc VKA phải làm các thủ thuật nhỏ.
Khoảng 15%-20% các bệnh nhân đang điều trị VKA cần làm các thủ thuật nhỏ về răng, da, hoặc về mắt.
Những thủ thuật nhỏ về răng bao gồm: nhổ răng, endodontic( root canal)( bảng 4S)
Các nghiên cứu có giá trị thấy rằng: dùng liên tục VKA và thêm thuốc prohemostatic hay ngưng VKA 2-3 ngày trước thủ thuật đều có nguy cơ chảy máu thấp, mặc dù nguy cơ chảy máu rỉ rả tại nứu răng nhiều hơn nhóm ngưng hoàn toàn VKA( 5 ngày trước thủ thuật), tỉ lệ thuyên tắc huyết khối thấp( <0.1%).
Các thủ thuật nhỏ về da bao gồm: rạch vào ung thư da màng đáy và vảy, actinic keratosis, tiền ung thư hoặc ung thư nốt ruồi. Các nghiên cứu đoàn hệ tiền cứu thấy rằng nguy cơ chảy máu ít và không nhiều cao hơn gấp 3 lần trong nhóm dùng liên tục VKA so với nhóm ngưng VKA trước thủ thuật. Hầu hết các chảy máu này tự cầm. Nguy cơ chảy máu nhiều quanh thủ thuật trong nhóm dùng liên tục VKA thì thấp(<5%).
Mổ cataract là thủ thuật trên vùng không mạch máu, đã có một số báo cáo cáo tỉ lệ chảy máu nặng <3%. Trong một số phân tích của nghiên cứu quan sát trên bệnh nhân dùng VKA liên tục làm tăng nguy cơ chảy máu( OR=3.26; 95% CI, 1.73-6.16) với tần suất chảy máu 10%( 95% CI, 5-19). Hầu hết chảy máu tự cầm, bao gồm dot hyphemas hoặc chảy vùng subconjunctival và không có bệnh nhân nào bị bệnh về mắt liên quan chảy máu.
Các dữ kện cho thấy < 1% thủ thuật gây chảy máu có hay không dùng VKA.
Đề nghị:
Những bệnh nhân làm các thủ thuật nhỏ về răng, đề nghị không ngưng VKA và uống thêm thuốc prohemostastic hoặc ngưng VKA 2-3 ngày trước PT( 2C). Các thủ thuật nhỏ tại da, không ngưng VKA và phải cầm máu tại chỗ kỹ( 2C). Tương tự mổ cataract cũng không ngưng VKA( 2C).
- Cách điều trị chu phẫu trên bệnh nhân đang uống thuốc chống kết tập tiểu cầu.
- Ngưng thuốc chống tiểu cầu trước PT
Các thuốc ức chế chức năng tiểu cầu không thể phục hồi bao gồm: ASA, clopidogrel, ticlopidine và prasugrel. Sau khi ngưng bất kỳ các thuốc này, từ 10%-14% chức năng tiểu cầu được hồi phục, mất 7-10 ngày toàn bộ tiểu cầu được hồi phục.
Các thuốc ức chế chức năng tiểu cầu có thể phục hồi được( với kết quả tự giới hạn tùy thuộc vào đời sống bán hủy của từng thuốc): dipyridamole, cilostazol, các thuốc kháng viêm nonsteroides. Dipyridamole là thuốc chống tiểu cầu và dãn mạch, có thời gian bán hủy là 10 giờ nhưng vì phối hợp với ASA trong điều trị nên hiệu quả chống tiểu cầu của nó không thể hồi phục. Cilostazol, chất ức chế phosphodiesterase, có tác dụng và ức chế tiểu cầu, thời gian bán hủy 10 giờ. Các thuốc kháng viêm nonsteroides có thời gian bán hủy từ 2-6 giờ( ibuprofen, ketoprofen, indomethacin) đến 7-15 giờ( clecoxib, naproxen, diflunisal), và>20 giờ( meloxicam, nabumetone, piroxicam).
Không có thử nghiệm lâm sàng nào đánh giá thời gian chuẩn để ngưng thuốc chống tiểu cầu trước mổ, đặc biệt có hay không việc ngưng thuốc 7-10 ngày trước PT hoặc sát ngày PT ảnh hưởng đến kết quả chảy máu và thuyên tắc do huyết khối.
- Sử dụng lại thuốc chống tiểu cầu sau PT
Khi dùng lại ASA, hiệu quả chống tiểu cầu xảy ra tối đa trong vài phút, ngược lại clopidogrel với liều duy trì( 75mg/ngày), mất 5-10 ngày mới đạt được chức năng ức chế tiểu cầu tối đa. Với liều tấn công 300-600mg/ngày, khả năng ức chế tiểu cầu tối đa 12-15 giờ. Các nghiên cứu đoàn hệ trên bệnh nhân dùng VKA và ASA, thời điểm dùng ASA bằng với thời điểm dùng VKA, trong vòng 24 giờ sau PT trên đa số bệnh nhân.
- Các xét nghiệm theo dõi điều trị thuốc chống tiểu cầu.
Nhiều xét nghiệm về chức năng tiểu cầu đo lường hiệu quả chống tiểu cầu của ASA và clopidogrel trên bệnh nhân PT tim hay nong mạch vành qua da. Tuy nhiên về ý nghĩa lâm sàng thì không chắc chắn và kết quả của nó không tiên đoán được kết quả lâm sàng. Cần nghiên cứu thêm trước khi ứng dụng lâm sàng đặc biệt trong PT ngoài tim.
- Các thủ thuật nhỏ về răng, da, mắt
Trong các thủ thuật nhỏ về răng, nhiều nghiên cứu nhỏ(<100 bệnh nhân) không thấy tăng nguy cơ chảy máu nhiều khi dùng liên tục ASA, ASA phối hợp clopidogrel.
Đối với các thủ thuật nhỏ về da, nhiều nghiên cứu đoàn hệ tiền cứu thấy rằng nguy cơ chảy máu nhiều rất thấp( <1%) khi không dừng ASA, các nghiên cứu này cũng thấy tăng nguy cơ chảy máu lượng ít so với nhóm không điều trị chống huyết khối, tần suất thay đổi rộng 2%-51% có lẽ do định nghĩa khác nhau mức độ chảy máu ít.
Bệnh nhân PT cataract, tỉ lệ chảy máu nhiều thấp(< 1%) khi dùng liên tục ASA. Tần suất các biến cố tim mạch trong một nghiên cứu đoàn hệ như nhau trong trong nhóm dùng liên tục ASA và nhóm ngưng ASA( 0.2% vs 0.65%). Không có nghiên cứu đánh giá trên bệnh nhân dùng đơn độc clopidogrel phải làm các thủ thuật về răng, da, mắt.
Đề nghị
Các bệnh nhân đang điều trị ASA đề dự phòng thứ phát các bệnh lý tim mạch và phải làm thủ thuật nhỏ về răng, da, mổ cataract, đề nghị dùng liên tục ASA hơn là ngưng trước thủ thuật 7-10 ngày(2C).
Các PT ngoài tim:
Trong thử nghiệm từ 19000 bênh nhân ( dự phòng thuyên tắc phổi do huyết khối) so sánh dùng liều thấp ASA trước PT thay hoặc sửa khớp háng và dùng liên tục 35 ngày sau PT với nhóm placebo. Nhóm dùng ASA làm tăng tỉ lệ thấp chảy máu nhiều ( 2.9% vs 2.4%, p=0.4), làm giảm nguy cơ VTE sau PT( RR, 0.71; 95% CI, 0.54-0.94).
Trong một thử nghiệm ngẫu nhiên nhỏ thấy rằng bệnh nhân nguy cơ cao các biến cố tim mạch phải PT ngoài tim dùng ASA( 75mg/ ngày) hoặc placebo 7 ngày trước PT và liên tục 30 ngày sau PT. Nghiên cứu này thấy rằng dùng ASA chu phẫu làm giảm có ý nghĩa NMCT và các biến cố tim mạch lớn(1.8% vs 9.0%, p=0.02%), nhưng nghiên cứu này không đủ mạnh để thấy sự khác biệt về kết quả chảy máu. Tuy nhiên bệnh nhân PT trong sọ, tuyến tiền liệt làm tăng chảy máu khi dùng ASA liên tục chu phẫu, do vậy trên những bệnh nhân này phải xem xét thận trọng, nghiên cứu này không báo cáo các kết quả về biến cố tim mạch. Các dữ kiện này cho thấy những bệnh nhân có bệnh lý mạch vành hoặc các bệnh tim mạch khác được xếp vào nhóm nguy cơ trung bình hay nguy cơ cao các biến cố tim mạch chu phẫu có thể có lợi khi dùng liên tục ASA chu phẫu. Các bệnh nhân thuộc nhóm nguy cơ trung bình đến cao bao gồm bệnh tim thiếu máu cục bộ, suy tim còn bù, tiểu đường, suy thận, bệnh mạch máu não. Ngoài ra, các PT được kết hợp với gia tăng nguy cơ biến cố tim mạch chu phẫu: PT bóc tách nội mạc mạch cảnh, bắc cầu động mạch ngoại biên sẽ có lợi khi dùng liên tục ASA. Bệnh nhân thuộc nguy cơ thấp các biến cố tim mạch ít gặp thuận lợi hơn khi dùng liên tục ASA.
Vài nghiên cứu đánh giá dùng liên tục clopidogrel chu phẫu, cho thấy tăng nguy cơ chảy máu chu phẫu, và nếu dùng đơn độc clopidogrel tăng nguy cơ chảy máu 33% hơn là dùng đơn độc ASA( risk ratio, 1.33; 95% CI, 1.11-1.59).
- Bệnh nhân thuộc nhóm nguy cơ trung bình đến cao các biến cố tim mạch đang dùng ASA và phải PT ngoài tim, đề nghị dùng liên tục ASA quanh PT hơn là ngưng trước 7-10 ngày( 2C). Bệnh nhân thuộc nhóm nguy cơ thấp, nên ngưng ASA trước PT 7-10 ngày( 2C).
- Bệnh nhân có PT bắc cầu mạch vành:
Nghiên cứu đoàn hệ >11000 bệnh nhân PT CABG, truyền nhiều máu làm tăng nguy cơ tử vong( risk ratio, 1.77; 95% CI, 1.67-1.87) cũng như suy thận và các biến cố thần kinh.Các nghiên cứu quan sát và phân tích khác cho thấy tăng nguy cơ chảy máu chu phẫu trên bệnh nhân dùng liên tục ASA có PT CABG, nhưng không cần mổ cầm máu lại. Ngược với tăng nguy cơ chảy máu, một nghiên cứu đoàn hệ trên 8000 bệnh nhân dùng ASA trong vòng 5 ngày trước PT, thấy giảm tỉ lệ tử vong và không tăng nguy cơ PT cầm máu lại hoặc truyền máu. Một nghiên cứu quan sát khác, thấy giảm các biến cố tim mạch và tử vong trên bệnh nhân dùng liên tục ASA trước PT CABG.Tuy nhiên, vì không chắc chắn giữa nguy cơ tương đối và thuận lợi của việc dùng liên tục ASA, các bs có thể tùy thuộc từng bệnh nhân để điều trị, ví dụ có thể ngưng ASA trên bệnh nhân bệnh mạch vành ổn định cần PT CABG.
Trong một phân tích dưới nhóm của một nghiên cứu lớn trên bệnh có hội chứng mạch vành cấp đang uống 2 thuốc ASA và clopidogrel cần PT CABG, đã thấy tăng 50% chứng cớ chảy máu nhiều và 70% cần truyền máu trên bệnh nhân uống clopidogrel trong vòng 5 ngày trước PT CABG, và nguy cơ này giảm nhiều nếu ngưng clopidogrel ít nhất 5 ngày trước PT.
Bệnh nhân đang uống 2 thuốc ASA và clopidogrel phải PT CABG khẩn, để giảm nhu cầu truyền máu, truyền tiểu cầu trước PT và dùng thêm thuốc tranexamic acid hoặc e-aminocaproic acid.
Đề nghị:
Bệnh nhân đang uống ASA và cần phải PT CABG, đề nghị tiếp tục dùng liên tục ASA quanh thời điểm PT hơn là ngưng 7-10 ngày trước PT(2C). Bệnh nhân đang uống 2 thuốc chống tiểu cầu cần PT CABG, đề nghị dùng liên tục ASA quanh PT và ngưng clopidogrel/prasugrel 5 ngày trước PT hơn là dùng liên tục 2 thuốc quanh PT( 2C).
- Bệnh nhân có đặt stent mạch vành phải PT
Một nghiên cứu hồi cứu trên 17,797 bệnh nhân đặt stent, thấy rằng 11% bệnh nhân phải PT trong 2 năm sau đặt stent và 4% phải PT trong 1 năm sau đặt stent.
Trong nghiên cứu hồi cứu >2,200 bệnh nhân phải PT trong 2 năm sau đặt stent, tần suất huyết khối stent sau PT 2%-5%.
Chứng cớ gián tiếp từ bối cảnh không phải PT, thấy rằng ngưng sớm 2 thuốc chống tiểu cầu trong 6 tuần đặt stent không phủ thuốc( bare-metal), trong 3-6 tháng đối với stent phủ thuốc làm tăng nguy cơ huyết khối trong stent. Mặt khác, khi PT bắc cầu mạch vành, dùng liên tục 2 thuốc kháng tiểu cầu chu phẫu làm tăng nguy cơ chảy máu gây chèn ép tim cấp đe dọa tính mạng.
Vai trò của điều trị cầu nối kháng đông trên bệnh nhân đặt stent mà phải PT chọn lọc thì không chắc chắn. Chỉ có vài trường hợp báo cáo đánh giá thuốc chống huyết khối có tác dụng ngắn như: UFH, LMWH hoặc chống thụ thể glycoprotein IIb/IIIa( ví dụ: tirofiban, eptifibatide) trong giai đoạn chu phẫu.Các thuốc chống huyết khối có tác dụng ngắn trên những bệnh nhân cần ngưng tạm thuốc chống tiểu cầu thì không thích hợp.
Đề nghị
Bệnh nhân có đặt stent và đang uống 2 thuốc chống tiểu cầu cần PT, đề nghị trì hoãn PT ít nhất 6 tuần sau khi đặt stent không phủ thuốc và ít nhất 6 tháng sau đặt stent phủ thuốc hơn là PT trong giai đoạn này( 1C). Nếu phải PT trong giai đoạn này, phải duy trì cả 2 thuốc quanh thời điểm PT hơn là ngưng thuốc 7-10 ngày trước PT( 2C).
- Điều trị chu phẫu trên bệnh nhân đang dùng cầu nối kháng đông heparin.
- Cầu nối kháng đông: thuốc và liều thuốc
LMWH hoặc UFH không nên cho lại tại thời điểm cố định sau PT hoặc thủ thuật mà không xem xét nguy cơ chảy máu hay tình trạng cầm máu sau PT.
Nếu dùng cầu nối kháng đông ở liều điều trị trên bệnh nhân nguy cơ cao chảy máu sau PT, nên trì hoãn 48-72 giờ sau PT khi chảy máu sau PT ổn. Nếu vẫn tiếp tục chảy máu sau 72 giờ, nên dùng heparin liều thấp hoặc VKA đơn độc mà không có cầu nối kháng đông sau PT.
- Sử dụng UFH tĩnh mạch chu phẫu:
Truyền tĩnh mạch UFH để đạt được aPTT 1.5-2 lần chứng là chiến lược sử dụng kháng đông chu phẫu. Bệnh nhân bị suy thận nặng hoặc phụ thuộc vào thẩm phân phúc mạc, tránh dùng LMWH thay vào đó dùng UFH. Chưa có nghiên cứu đánh giá thời điểm ngưng UFH IV. Tuy nhiên thời gian bán hủy tùy thuộc liều là 90 phút( 30-120 phút), nên cho rằng ngưng trước PT 4-6 giờ.
Đề nghị
- Bệnh nhân đang dùng cầu nối kháng đông với liều điều trị UFH tĩnh mạch, đề nghị ngưng UFH trước PT 4-6 giờ hơn là dùng đến sát PT( 2C).
- Bệnh nhân đang điều trị LMWH tiêm dưới da phải PT với nguy cơ cao chảy máu, đề nghị sử dụng lại sau PT 48-72 giờ hơn là trong 24 giờ sau PT( 2C). Những bệnh nhân trên phải PT mà không thuộc nguy cơ cao chảy máu, đề nghị dùng lại liều điều trị LMWH khoảng 24 giờ sau PT hơn là dùng trễ hơn 24 giờ sau PT.
- TÓM LẠI:
Bệnh nhân đang điều trị thuốc kháng vitamin K( VKA) nếu ngưng thuốc trước PT, ta nên ngưng trước 5 ngày hơn là ngưng sát ngày PT( 1B). Bệnh nhân có van tim nhân tạo, rung nhĩ, hoặc thuyên tắc tĩnh mạch thuộc nhóm nguy cơ cao thuyên tắc do huyết khối nên dùng cầu nối kháng đông khi ngưng VKA hơn là không dùng(2C); những bệnh nhân thuộc nhóm nguy cơ thấp, không dùng cầu nối kháng đông( 2C). Bệnh nhân cần làm các thủ thuật răng miệng, nên tiếp tục dùng VKA và uống prohemostatic hoặc ngưng VKA 2-3 ngày trước khi làm các thủ thuật( 2C). Nhóm nguy cơ trung bình- nguy cơ cao, bệnh nhân đang điều trị ASA và cần làm các thủ thuật ngoài tim, đề nghị dùng ASA liên tục đến ngày PT hơn là ngưng 7-10 ngày trước PT(2C). Bệnh nhân có đặt stent mạch vành mà PT, đề nghị trì hoãn PT> 6 tuần sau khi đặt stent không phủ thuốc và> 6 tháng đối với stent phủ thuốc hơn là PT trong thời gian này( 1C); nếu cần phải PT trong thời gian này, nên dùng liên tục thuốc kháng tiểu cầu chu phẫu hơn là ngưng 7-10 ngày trước PT( 2C).
- Kết luận:
Điều trị kháng đông chu phẫu dựa trên đánh giá nguy cơ thuyên tắc do huyết khối và chảy máu, điều trị đơn giản và giảm thiểu tác dụng không mong muốn trên lâm sàng.
TÀI LIỆU THAM KHẢO:
1. Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine(2005).
2. Frederick A. Anderson, Jr., PhD, and Frederick A. Spencer, MD: Risk Factors for Venous Thromboembolism. Circulation. 2003;107,I-9-I-16.
3. James D. Douketis, Peter B. Berger, Andrew S. Dunn, Amir K. Jaffer, Alex C. Spyropoulos, Richard C. Becker and Jack Ansell: The Perioperative Management of Antithrombotic Therapy ACCP Evidence-Based clinical Practice Guidelines( 8th Edition): American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest.2008 ;133;299S-339S.
4. James D. Douketis , MD , FCCP ; Alex C. Spyropoulos , MD , FCCP ; Frederick A. Spencer , MD ; Michael Mayr, MD ; Amir K. Jaffer, MD , FHM ; Mark H. Eckman , MD ; Andrew S. Dunn , MD ; and Regina Kunz , MD , MSc ( Epi ): Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest.2012;141;e326S-e350S .
5.Generation practice Notebook- a UK medical reference.
6.Giao sư Phạm Tử Dương: Thuốc tim mạch.1999.




